(2016年10月15日更新) [ 日本語 | English ]
HOME > 講義・実習・演習一覧 / 研究概要 > 小辞典 > レンズ
|
蜃気楼 mirage: 熱(冷気)のため大気中で光が屈折し、空中や地上に何か物が有るように見える現象 ガリレイ光学 Galilean optics光エネルギー: 発光体luminous body (発光emission)
→ 入射(光)線incident ray
Ex. 1/0.5 × (-1) = -2D レンズ lens, L光の広がりを変える特性を持つ物体ジオプタ度数 diopter power: レンズ度数をジオプタで表したもの 口径 aperture: 穴・管等の円筒形物内径(垂直断面の内側直径) (aperture: 隙間, 開口)
1. 円筒形物の内径 f値 f-number: レンズの焦点距離を入射瞳径(レンズの光束の大きさ)で割った値 A) プラスレンズ(+レンズ)= 凸レンズ convex lens (converging lens)ジオプター増 = 発散 dispersion 減
Ex. +3Dのレンズを0.5 mの点に置く 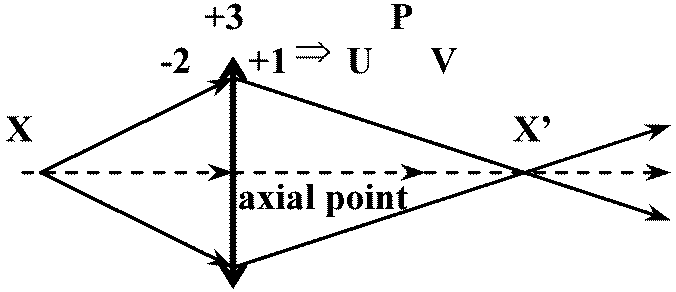 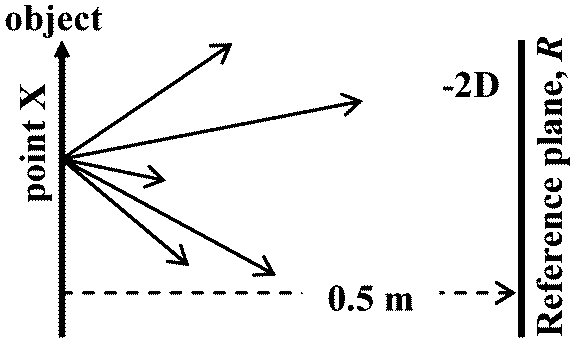
Cf. 鏡の公式 mirror equation 光軸 optical axis: 光曲がらず通過→ 軸上点axial point (≈ 節点 nodal point - 薄レンズで概ね同じ)
X (点源 point source), X' (像点) ≡ 共役点 conjugate points - 像の発信源と受信点 → レンズ距離動かす: +3DレンズはXから33 cmの距離で無限距離で像を結ぶ → 焦点面(焦平面) focal plane Def. 第1焦点 primary focal point (focus, pl. foci), F: 像点が無限となる距離
Ex. +14D → f = 1/(+14) ≈ 0.0714 m Def. 第2焦点secondary focal point, F': 無限遠上の物点の像を結ぶ
→ U + P = -4 + 3 = -1 = V < 0
物体との距離 → 像との距離 |
B) マイナスレンズ(-レンズ)= 凹レンズ concave lens (diverging lens): ジオプター減 = 発散 dispersion 増
→ 像位置: X’ = -(1/7D) = -14.1 cm Ex. 2. X = ∞ → U = 0, P = -3 ∴ V = -3
→ X' = F'
+25 → +100
レンズに当たる前に物体面から出る光 = "物体空間"に位置する A. X-X' = 1 m, u = 物体の距離, v = 像の距離 → v = 1 - u
レンズは物体と像の間 → U = -1/u (レンズ面でのジオプターは負), V = 1/(1 - u) C) 複合レンズ複数の薄いレンズの組み合わせ → L1, L2, …, Li, … Ln
レンズ間に隙間がある → 像位置変化
L1 = +2D, L2 = +1D, L3 = -4D レンズ法則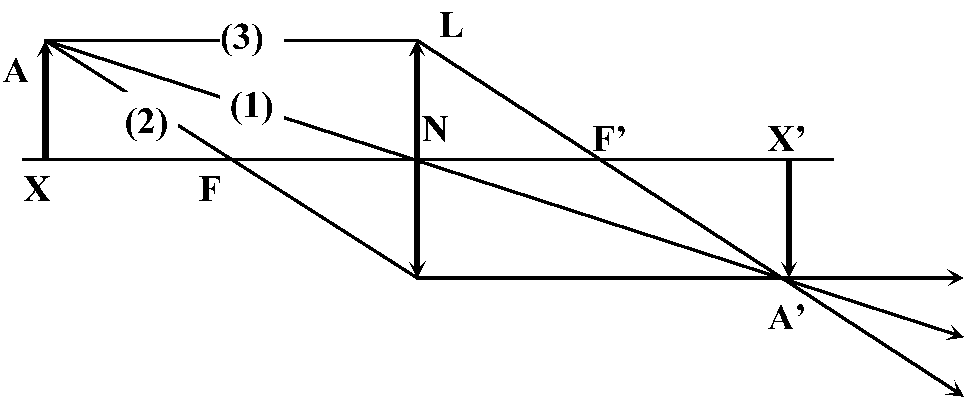
N: 節点, F: 第1焦点, F': 第2焦点
倍率 maginitude, M= (像の大きさ)/(物体の大きさ) = (像の距離)/(物体の距離)< 1 → 縮小 minification 直線倍率 linear magnification, M≡ I/O: 物体と像との大きさ(長さ)の比 → (空間屈折率を考慮しなければ)節点を通る光線のみで求められる 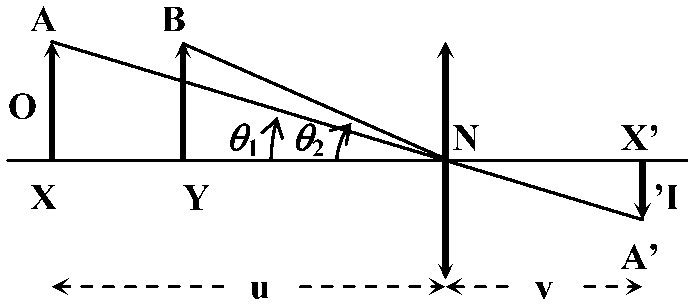
ΔAXN ∝ ΔA'X'N → I = A'X', O = AX, v = NX', u = XN Q. 映写レンズ F = 5 cm , 35 mmスライドフィルム u = 6 cm → 最適なスクリーンの位置と映し出される像の大きさを求めよ A. U + P = V → -1/0.06 + 1/0.05 = V = 1/v = +0.3 (= 30 cm) M = v/u = 30/-6 = -5 (= 5倍) ∴ 175 cmの大きさ(ただし倒立)
|
天体望遠鏡 astronomical telescopeガリレイ式望遠鏡 = 屈折型望遠鏡refracting telescope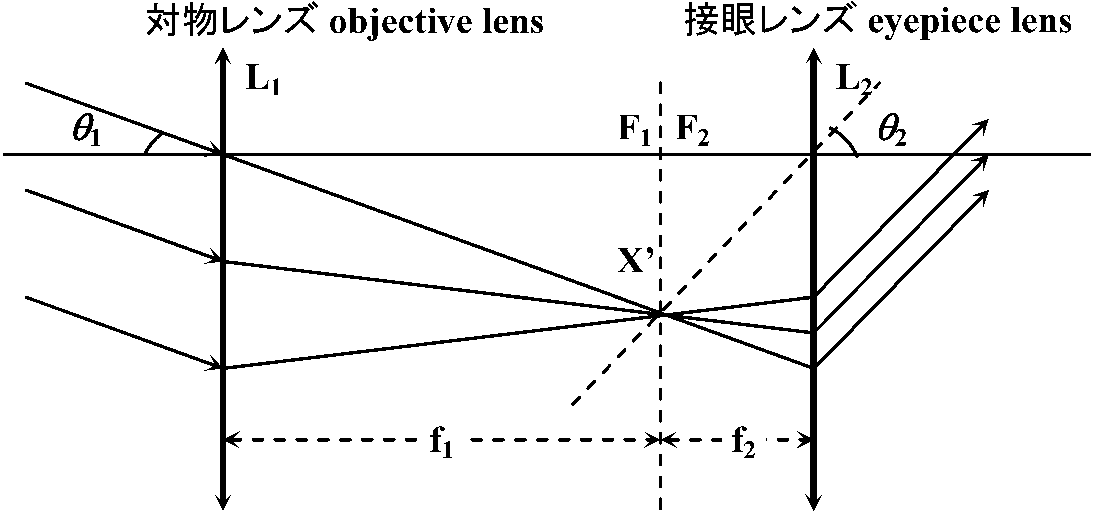
Cf. 反射型望遠鏡reflecting telescope 角倍率 angular magnification, M≡ |θ2/θ1|
≈ 見かけの大きさの比
魚眼レンズ fisheye lens 軸倍率 axial magnification∝ (直線倍率)2主要点 cardinal points: 6点(2主点 + 2節点 + 2焦点)
主点: 主平面のレンズ軸との交点 N: 第1節点, N': 第2節点 屈折 refraction物質の誘電率と透磁率から電磁波速度決まる = 物質固有値 → 物質境目で屈折発生屈折率 refractive index or index of refraction= 物質屈折率 index of refraction of a substance, nn = cv/cm
cv: 真空中の光速度(実用上は空気中でよい)
cv > cm → n > 1. 波長により異なる 相対屈折率 relative refractive index (relative index of refraction) フェルマーの原理 Fermat's principle= フェールマーの最小時間原理(最短時間の法則) Fermat's principle of least time2点間を結ぶ光の経路は、その所要時間を最小にする → スネルの法則導出 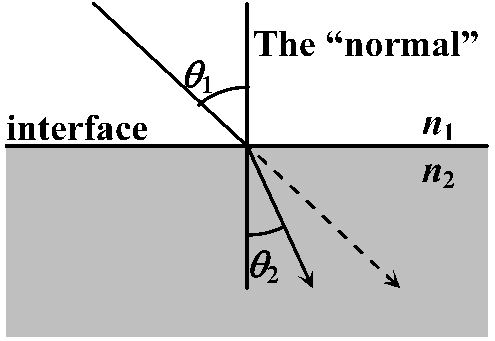
スネルの法則 Snell's lawn1sinθ1 = n2sinθ2
θ1: 入射角 incidence angle プリズムジオプター, Δ: 1 mで1 cm屈折距離を持つ角度 angle → tanθ = BC/AB
臨界角 critical angle≡ n1 > n2, θ2 ≥ 90°となるθ1 (sinθ1 ≥ n2/n1) → 屈折光存在しない→ 全反射 > 90° 平面屈折 1) 2つの平行面 Ex. 窓ガラス 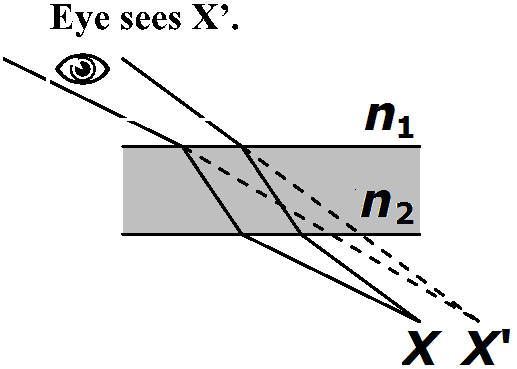
a) 光線が面に直角に入る → 光線偏位なし → 眼にはX'に物体があるように見える 2) プリズム prism: ガラスの両面が平行ではない
太陽スペクトル solar spectrum
分光器 spectroscope (spectrometer) 複屈折 double refraction 局面屈折
スネルの法則の角度が小さい時の近似: n1θ1 = n2θ2 → Eq. 1: n1(θ - α) = n2(θ - α')CP = r (曲率半径 radius of curvature), h ≈ 弧に近似 → θ = h/r 同様にα = h/u, β = h/v → Eq. 1に代入 hn1(1/r - 1/u) = hn2(1/r - 1/v), n1(1/r - 1/u) = n2(1/r - 1/v) → Eq. 2: 単一球面一般公式n2/v - n1/u = (n2 - n1)/r, or n1/u + (n2 - n1)/r = n2/v
n1/u ≡ U (object vergence) → U + P = V (P, 面屈折力) Q. 半径10 cmのガラス棒 (n = 1.50)の空気中での屈折率A. P = (1.50 - 1.00)/(+0.1) ∴ +5D Q. 水(n = 1.33)に入れた時の屈折率 A. P = (1.50 - 1.33)/(+0.1) ∴ +1.7D → 屈折率が3.3下がる P = 1/f1 = 1/f2 [薄いレンズで成立] → Eq. 3 [拡張]: Psurface = n1/f1 = n2/f2無収差像が鮮明に写る(点の様になる) ↔ 収差 aberration: 像が不鮮明に写る
色収差chromatic aberration (Cf. プリズム) → 2色テストbichrome (duochrome) test → 非点収差クロスダイアグラム cross diagram
円柱レンズ cylindrical lens → 放射状非点収差 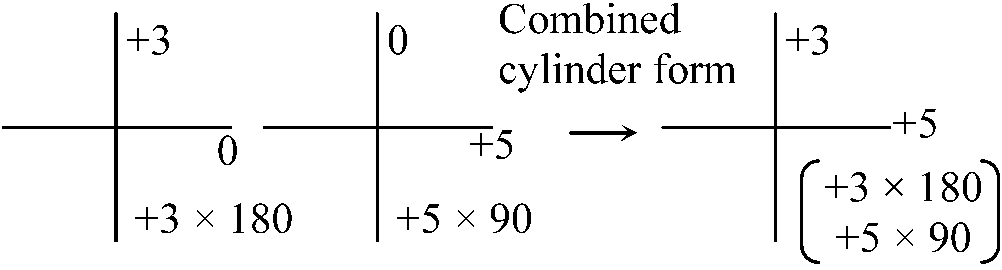
⌈ L1 × 90 = +0.75 × 90 ⌉ → 最小錯乱円は2つの焦点の中間になる 等価球面度数 spherical equivalent power ≡ 最小錯乱円を元にしたレンズ平均度数 レンズのプリズム効果PC = d: レンズ中心からの距離 f: (第2)焦点距離 → tanθ = d/f
|
A. P = 1/f = -1/0.985 = -12D → θ = 0.7 × (-12) = -8.4 反射 reflection平面鏡 plane mirror1) 全反射 total reflection (total internal reflection): 入射した全電磁波が反射される → 理想的導体表面の反射
θi = θr → 正反射(鏡反射) regular reflection ↔ 乱反射 diffuse reflection (irregular reflection) Ex. U = -2.5D (u = 40 cm), P = 0 → V = -2.5D (虚像) ライトパイプ light pipe:: 内面全反射により光を片端から他端に伝達→ 円柱形・ピラミッド形・円錐形等に引き出された透明な屈曲性固体の棒(の束) 球面反射Ex. 凹面鏡concave mirror ↔ 凸面鏡convex (converging) mirror
U + P = V → U + (-2/r) = V Ex. 凸面鏡, r = 20 cm, 50 cmに物 → 像
u = -50 cm, U = -2D, P = -2/r = -10D 導体表面: 入射した電磁波の電場を打ち消すよう電場生じる ? この電場により電磁波発生し放射される 2) 誘電体境界面の反射: 誘電体境界面では入射した電磁波の一部は反射、一部は屈折しつつ透過誘電体: 誘電分極が生じ電場の大きさ変化 → 電磁場境界条件を満たすには一部電磁波が反射される Ex. 水等の流体で急に水路の深さや幅が変わった時に、波の一部が反射され残りが透過する 反射の法則 law of reflection光ファイバー optical fiber: 内側への全反射を利用 → 内視鏡等にも利用 ファイバースコープ fiberscope: 数千-数万本を束にした光ファイバーによる軟性内視鏡 減衰 attenuation物質中を電磁波伝搬時、電磁波の電磁場により物質中の電荷が動き(電流)、電荷の運動エネルギーは熱に変わり電磁波はエネルギーを失い電磁波の電磁場は徐々に振幅が小さくなる。導電率の大きい(= 抵抗小)物質は電流を流しやすく電磁波は早く減衰する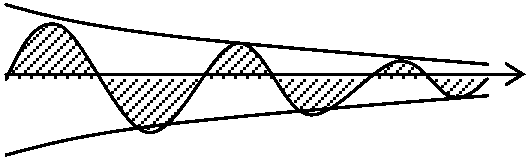 この減衰の仕組は高エネルギー電磁波(X線等)に適用できない。高エネルギー線は、電荷(分子や電子)の位置を変えるだけではエネルギーは吸収されず、原子核から電子をはぎ取ることでエネルギーを失う
この減衰の仕組は高エネルギー電磁波(X線等)に適用できない。高エネルギー線は、電荷(分子や電子)の位置を変えるだけではエネルギーは吸収されず、原子核から電子をはぎ取ることでエネルギーを失う
フーリエ解析波動の周波数解析。全ての波は正弦波の重ね合わせで作られ、各周波数成分に分解もできる。音波は空気振動だが、それを高音成分、低音成分等に分解できるのはこの解析法に基づく
左右円偏光 回折 diffraction電磁波が障害物の後方にも伝わること不透明物質 opaque substance (不透明材料 opaque materials)の側を光が通る → 回折 ↔ 透明物質transparent substance (透明材transparent materials) (adj. transparent透明な) → 回折なし 半透明物質translucent substance (半透明材translucent materials) (adj. translucent半透明な): 様々
回折角 diffraction angle ブラッグの式 Bragg equation: nλ = 2dsinθ
n: 正整数
Ex. AOB, A'O'B' → 光路差 optical path difference: 波の辿る道のりの差 Ex. A'O'B' - AOB Def. 2. ブラッグの法則: 光路差が波長の整数倍のときに回折する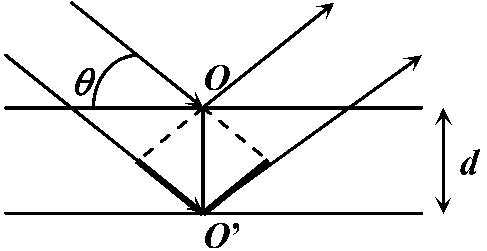 → 太線の部分が光路差 = 2dsinθ
→ 太線の部分が光路差 = 2dsinθ左右対称格子面でのみ回折は起こる → 回折格子 grating (diffraction grating) ブラッグ反射 Bragg reflection (回折)格子定数 grating constant (lattice constant) X線回折, 電子線回折 electron diffraction 散乱 scattering散乱度 ∝-1 波長 → 青色(可視光中で短波長)は赤色より大きく散乱 = 青空水平線に近い(大気を通過する距離長い) = 散乱度高 → 全てが散乱 (?) 後方散乱backscattering測光 photometry → 光度計(測光器) photometer, 光検知器(光検出器) photodetector 露光(露出) exposure レーザー laser= light amplification by stimulated emission of radiation)増幅された平行な光線 自然放射(自然放出, 自発放射) spontaneous emission: 外部からのエネルギーに関係なく放出されるエネルギー Ex. 励起状態b → fab(Eb - Ea)/hの光を放射 → 基底状態aに遷移 ↔ 誘導放射(誘導放出) stimulated (induced) emmision: 入射光を与え放射光を発生させる励起された電子・原子が他の定常エネルギー状態に移る際、外部から加えられた電磁波(光)等のエネルギーと同じ位相や周波数のエネルギーを放出する現象
┌→ 原子にfabの光を入射しfabの光を放射させる
│ 誘導放射された光と入射光は、進行方向・位相が同じ
│ ⇒ 干渉により増幅される
└───┘ 反復により増幅 ⇒ レーザー
自由電子レーザー free electron laser 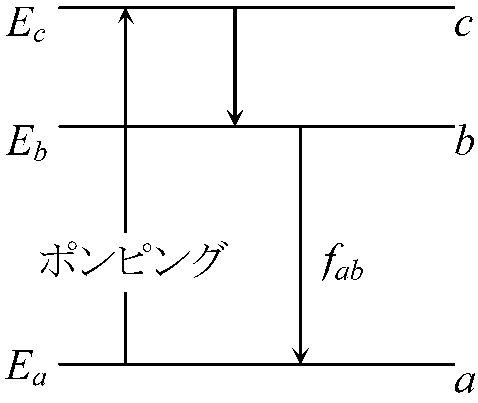
ポンピング pumping室温熱平衡状態 → 殆どの原子は基底状態(Ea)
→ レーザーは原子数がEa < Ebでなければ発生しない(誘導放射が増幅されない) a → c → b のサイクル
光沢 luster → 金属光沢metallic luster 冷光 luminescence→ シンチレーション(蛍光作用) scintillationEx. 蛍光 fluorescence (adj. fluorescent): 蛍光灯 fluorescent light, 蛍光体(燐光体) phosphors, 点状蛍光体 phoshor dots, リン光 phosphorescence |
顕微鏡の世界(種類)虫眼鏡(拡大鏡) magnifying glass → 拡大レンズ(単顕微鏡, 拡大器) magnifier複顕微鏡
双眼顕微鏡 binocular microscope 電子顕微鏡 electronic microscope (EM) + 超薄片技術 |
透過型電子顕微鏡 transmission electron microscope (TEM)
細胞小器官観察 → 固定死細胞のため生細胞との違いを意識する
走査型トンネル顕微鏡 (STM) 顕微鏡観察
|
使用法鏡身を右手で握り、左手を鏡台に添え箱から取り出し机上に置く。直射日光下避ける。正しい姿勢で腰掛け、体の真中に顕微鏡を置く。腰掛高を変え、目の位置を適当にし検鏡。悪姿勢での検鏡は疲労を早めるレンズ汚れはエーテル-アルコール混液を浸したガーゼで拭き除く。ステージ自然降下や粗動ハンドルが硬すぎる時は、左右粗動ハンドルの同時逆回転で調節できる → 処置は勝手に(自己流で)やらない 接眼レンズをつけたまま収納(レンズを始め機械部分解手入は精度を落とす原因) → いたずらに分解しない I 構造鏡脚(台足) base, foot鏡柱(柱部) arm 関節(屈曲装置) inclination joint ステージcentering screw, mechanical stage: 遊尺の読み方 鏡筒: 器械的筒長 = 標準筒長 160 mm 対物レンズ交換装置objective changer: レボルバーrevolving nose-pieceの回し方 焦準装置(coarse adjustment, fine adjustment):
測微ラセンmicrometer screw: 鏡筒の上下運動を1-2 μまで読み取れる。物体の厚さを計るのに利用 1) 対物レンズの種類アクロマート achromatic 対物レンズ: Fraunhofer線のうちの赤と青の線の色収差の補正アポクロマート apochromatic 対物レンズ: さらに黄についても補正 プラン-アポクロマート plan-apochromatic 対物レンズ: 色収差、像面湾曲収差も補正した最高級レンズ。写真撮影にも最適 2) 対物レンズの分解能= 解像力 resolving power (of lens), h): 近接した2点が2点として見える度合h = λ/2NA = λ/(n × sin(u/2)) = 0.61λ × NA
λ: 光源側波長 開口数 numerical aperture, NA = n × sin(u/2), (maximum = 1.3)
可視光線平均波長: 0.55 μ、シーダー油のn: 1.515 → 光学顕微鏡分解能限界 δ = 0.55/1.4 = 0.39 μ 電子顕微鏡(electric microscope, EM)のλ
NA 0.005 A (∝-1 粒子速度), λ: 0.054 A: 電子線のλ 3) 接眼レンズ ocular, eyepieceハイゲンスHyghens型接眼レンズ: 2枚の平凸型レンズからなる。アクロマート対物レンズと併用補正接眼compensating ocular: アポクロマート対物と併用。K8Xと刻む ペリプラン接眼レンズ: 色収差、像湾曲も修正。視野周辺まで平らに見え、顕微鏡写真撮影にも適 実視野直径(実際観察している標本面直径) = (対物レンズ視野数)/(対物レンズの倍率); 18/20 = 0.9 (mm) (眼鏡をつけた人は高アイポイント接眼レンズが便利。双眼の方が疲労少) コンデンサアクロマートコンデンサ: 色収差のみ補正アクロマート・アプラナートコンデンサ: 色収差・球面収差補正 油浸対物レンズのようにNAが1.25-1.30もある対物レンズを使用する場合、コンデンサの後端面とスライドグラスとの間を油の層にすると対物レンズの分解能を十分に発揮できる II 手入れ原則: 丁寧・清潔。対物レンズと微動装置は、素人手入れ不可能レンズ手入 埃は軟かい清潔な毛筆(羽毛)で払い落とすかゴム球で吹き払う。レンズペーパー(ガーゼは糊を落として)で軽く拭く。蒸留水を少しつけ拭く。キシロール(クロロフォルム)を少量ガーゼに浸し拭き、すぐ乾いたガーゼで拭き取る |
長期保管: 箱 cabinet に納め保管。備品管理には台帳を利用
使用上の注意
短期間使用しない場合は覆い(通例、ビニール製カバー)を被せる。頻繁に使用する場合でも、顕微鏡カバーの使用をまめにする。対物レンズはガーゼで包む。直射日光、急激な温度変化を避ける III 顕微鏡の見方0. 照明装置 illuminating apparatus反射鏡 mirror絞り diaphragm コンデンサ condenser フィルター支持枠 light filter 照明装置(アッペ、ケーラー) 光源(自然光源・人工光源) 1. コンデンサcondenser絞りの使用法
2. 光源絞り絞りは明るさと焦点深度との兼ね合いを考えつつ開閉 → 全開は周辺ボケを起こすので不可3. ケーラー照明手順
4. 位相差顕微鏡1) 原理: 位相差 → 厚さや屈折率の違う試料を通った光波のずれ無色透明だが屈折率異なる部分のある試料観察 → 屈折率大きな媒質中を通る光は、屈折率小さい媒質中を通る光よりも位相遅れる → この位相差に関わる回折光を利用 2) 位相差顕微鏡の実技
|
撮影チェックリスト顕微鏡部分光軸調整1. 視野絞りの像は中心に 2. 非プリセンター電球ではフィラメントが光軸中心に来る 撮影装置部分1. 光学系にゴミ付着ない2. フィルム巻上げ時送られている 3. フィルムASA感度セットは(NEOPAN F: ASA 8)できている 4. ファインダー内2重線(視野補正)は明瞭にみえる |
撮影テクニック標本観察し眩しければNDフィルター入れる標本観察でフレアー(霞)がかかる → 指紋等汚れが光学系にある コンデンサー絞りは通常7:3 → 絞るほど解像度落ちる 視野絞りは、視野に外接するまで絞りこむ 露出決定
露出アンダー → 視野内試料の輝度差大きい時 レリーズボタンはソフトタッチで 大きさ測定ミクロトーム microtome: 材料を数ミクロンの厚さに切る装置接眼ミクロメータ micrometer、対物ミクロメータ使用: 原則、対物ミクロメータ1目盛は10 μm |
|
= 電子(線)をあて拡大する顕微鏡 1924 de Broglie: 電子顕微鏡理論 1939 電子顕微鏡発明(Siemens-Halske杜) a) 透過型電子顕微鏡 transmission electron microscope, TEM観察対象に電子線あて透過した電子を拡大観察。対象構造や構成成分差により電子線透過量異なるので、透過電子密度変わり顕微鏡像となる。電磁コイルを用い透過電子線を拡大し、電子線により光る蛍光板にあて観察しCCDカメラで写真撮影。観察対象を透かし観察するため薄片や電子線透過フィルムの上に塗りつけ観察b) 走査型電子顕微鏡 scanning electron microscope, SEM観察対象に電子線あて反射した電子(か2次電子)から得た像観察。対象に電子線を当てる位置をずらしスキャン(走査)し顕微鏡像形づくる。電子は検出器に集めコンピュータ処理2次元像表示する[長所] 対象表面形状や凹凸、表面に近い部分の内部構造観察 [短所] 観察対象導電性ない → 電子線連続照射で表面帯電し反射電子パターン乱れる → 観察対象表面を予め導電性物質で薄くコーティング 走査型トンネル顕微鏡scanning tuuneling microscope (STM) フリーズエッチングfreeze etching technique (レプリカ法)
透過型電子顕微鏡をい、細胞や細胞内組織等の内外表面の三次元的微細構造を観察する方法
グリセロール浸漬した組織片 → 凍結 分解能 2-3 nm |
c) 走査型透過電子顕微鏡= scanning transmission electron microscope, STEMTEMとSEMの両特徴を持つ |
固定fixation細胞(組織)をできるだけ生きているままの状態で保存固定剤 (fixative)
カルノアのアルコール・クロロホルムchloroform・酢酸浸透力も凝固作用も強く激しい固定剤純アルコール:クロロホルム(局方):氷酢酸(局方) = 12 :6:2 (ml) 保存効くので数回分一緒に作ってもよい 固定時間5-60 min。比較的大きいものでも2 hr限度 - 長く置くと収縮強くなるパラフィン包埋前処理に利用 カルノアの酢酸・アルコール Carnoy's fluid純アルコール EtOH : 氷酢酸 acetic acid = 6:2 (= 3:1) (ml) (用途は上記と同) |
トレーサー tracer調査物の追跡を容易にするための物質染色 staining: 細胞(組織)各部を特異的に染める 染色剤: 主に細胞質を染める酸性色素と核質を染める塩基性色素がある 発色剤酸性色素(染料)
|
A) パラフィン包埋 paraffin embedding (general procedure)利点: 連続切片製作に優れる< br /> 難点: 切片作成に時間要する。有機溶媒使用するため物質により溶け去る、脱水・加熱を行なうため組織収縮強い。切片作成時に室温考慮する、大きな硬い組織に適しない自動包埋装置: 脱水からパラフィン浸透までを自動化 準備 preparation脱水: アルコールEt-OH、共栓ガラス瓶(○個)(無水アルコール(作成), セロイジン瓶(無水アルコール用)、無水硫酸銅、濾紙) 透徹: キシロール、共栓ガラス瓶(3個) 浸透: パラフィン(融点確認) - 包埋用、恒温器(2台, 37°C and 56°C)、共栓ガラス瓶、濾紙、コップ(浅い) 包埋: アルコール・グリセリン、時計皿(シャーレ代用可)、コップ、水槽、ピンセット、アルコールランプ 1) 脱水 dehydration: 固定を終えた組織片から水分を100%除く → アルコール置換による 各濃度アルコール作成: 無水(100%)、純(99%、95%)、局方(90%)、80%、70%、(必要に応じ50%) アルコール計alcoholmeter (比重計)かメスシリンダー(量水器) messylinderにより80%以下の濃度は作成 無水アルコール: 純アルコールを無水硫酸銅で脱水し作成 → 灰白色微粉末(硫酸銅は青色結晶) 濾紙を適当な大きさに切り袋を作り、その中に無水硫酸銅を入れ、端をくくり粉が漏れないようにする 共口試薬ビン(磨合せ注意)に純アルコールを入れ無水硫酸銅入り濾紙を2, 3浸す → 一晩で完成 無水硫酸銅が青色に変わったら、再生せず廃棄し、新しいものを用意する 脱水: 組織の入る共栓ガラスビン(× コルク栓)をアルコール濃度数分と無水アルコール用セイロジンビン用意
90%までの脱水所要時間は、小さな組織で1-2時間、通常1日で十分。大きな組織では2-3日でもよい
植物組織保存は、通常70%アルコールで行う
Ex. 1. 純Et-OHで短時間(1時間以内)処理後、クレオソート・キシロール(局方クレオソート2 + キシロール8)に移し30-40分置く(途中液を1回交換) → 純キシロールに移す パラフィンはアルコール不溶 → アルコール・パラフィン両方に溶ける物質(パラフィン誘導剤, 透徹剤)にまず浸しアルコールを完全に追い出した後にパラフィン浸透を行なう 透徹剤: キシロールxylol (xylen)、クロロホルム、ベンゾール、トルオール等 ガラスビン3個用意
a) 無水アルコール3・キシロール1 (無水硫酸銅敷いておく)
a-cの順で各ビン中に標準で20-30分程度漬けておく(時間長すぎると組織収縮する) パラフィン融点はミクロトーム切断時の室温を考慮し決める Ex. 室温10-19°C → 融点52-54°C (冬は若干低融点を使用) 恒温器incubator (thermostate)中実施 [重湯煎water bath代用可]
一台の内部温度をパラフィン融点より2-3°C高めに調節
透徹剤-パラフィン置換手順: パラフィン引火注意。コップを5-6個用意 a) 金属枠
金属枠2つととガラス(金属)板1枚が1組(できれば包埋する組織片の数だけ用意)
ミクロトームで切る時のことを考え、組織片の最初に切る面が底に当るよう置く ガラス板を静かに持ち上げ、水の入らぬよう気をつけながら、水平にバットの底に沈める そのまま固めるとパラフィンが収縮し中央が窪み気泡が入るので、2 mmほど窪んだら、焔で温めた匙で枠中のパラフィンの表面をなでて溶かし、注ぎ用コップから少量のパラフィンを匙ですくって足す パラフィンが冷めて固まったら取り出し、包埋片をはずす b) 時計皿(盃): 基本的には金属枠法に順ずる
時計皿内面にアルコール・グリセリン塗布 [包埋失敗時] パラフィンが全体均質な半透明になっていない場合はパラフィン結晶ができており、薄い切片とならないので、包埋までをやり直すべき。ただし、組織収縮が大きくなり精密観察には適さなくなる 結晶範囲が狭ければ、37°C程度の所に(数ヶ月となることもある)放置すれば結晶が消えることがある |
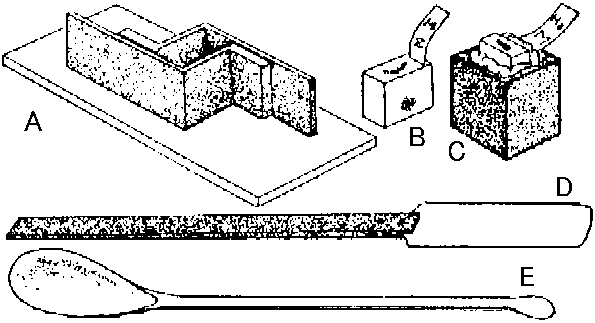 図23. パラフィン包埋用具と包埋片。A: 包埋用金属枠とガラス板。B: 包埋片。一端に記号札つける。C: 包埋片を台木に密着させた所。D: スパチュラspatula。E: 包埋用匙 5) 切片: ミクロトーム使用
台木(2 cm程度のサイコロ形)につける: 組織片の切り始めの部分を確認し、その 面を上に向け、台木にパラフィン(融点同)をスパチュラ等を焔で温めて貼り付ける
毛筆2本 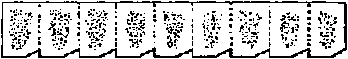 図. 包埋片の方向とリボン形: 刀長軸に対し包埋片の長辺を平行に置いて切った場合のリボン。この形がよい。包埋片の1隅を削ってあるので切片境界が分かりやすい ミクロトームの傾斜 [切り方 sectioning]
(1) 刀台取手に指をかけ左手親指と示指で微動装置ハンドルを摘み、刀台を手応えのあるまで向こう端に押しやる → (2) 刀台取手を持ち静かに引く → [1枚目できる] → (1)に戻る = 連続切片 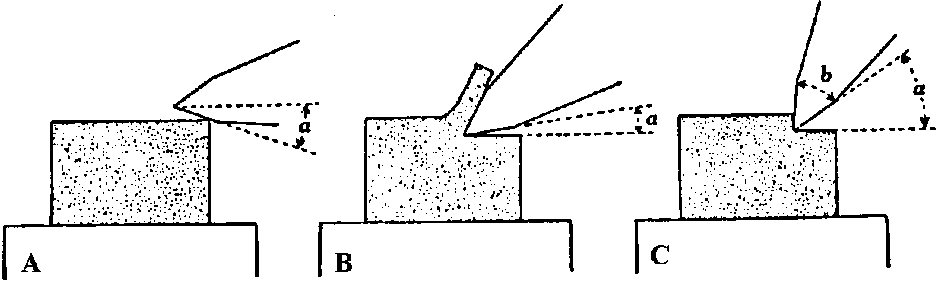 A: 傾斜足りず切れない(逃角負)。傾斜(約5°)適当。C: 傾斜強すぎ良く切れない。逃角(スカシ角) clearance angle (α)。b: 刃角 b) 回転式ミクロトーム: 基本的には滑走式ミクロトームに順ずる。準備も同じ
回転版の調子確認が一番重要
パラフィン切片作成準備パラフィン伸展器 - 自動温度調節のついた電熱式がよい 載ガラス slide glass - 埃つかないよう注意 卵白グリセリン 鶏卵卵白を容器に移し泡立器等で雪のような泡を立てる。ロートに濾紙をのせ、その上に卵白泡を盛り上げ、ロートの上に小瓶をおくと数時間-一晩で濾過され透明液が溜まる。これに等量グリセリンを加え、瓶を傾けながら静かに混ぜる。腐敗・微生物発生防止にチモール小塊を1%混ぜ完成 きれいな水を満たした器1個(ビーカー等)解剖刀、ガーゼ、黒い下敷き 貼り方 適当な温度(包埋に使ったパラフィンの融点より5-6°C低め)の湯を進展器に充たす 載ガラスに卵白グリセリンを塗る → ガーゼで塗りすぎた分を拭く 毛筆に水を含ませ卵白グリセリンを塗った載ガラス上に薄く広げる → 水滴形成は脂肪があるのでやり直し 連続切片リボンを適当な長さに解剖刀で切る リボンを水を含む毛筆で触れれば付くので、それを載ガラスの水の層の上に並べる 並べ終わったら切片の下に水が行き渡っていることを確かめ、足りなかったら毛筆に含ませ補充する 載ガラスを水平に持ち上げ温めた伸展器の上に置く → 切片がやや透明になる 水が蒸発しないうちに伸展器から降ろし、載ガラスを傾け余分な水を捨て、針と解剖刀を使い切片を並べる 載ガラスを再び伸展器上に載せ、ガラスの一端をガラス棒にかけて僅かに傾斜させる → 水分が低い方に集まり間もなく乾いて載ガラスに密着 載ガラスの端に必要情報を記し、金属製枠(マッペ)に並べ埃の届かない所で完全に乾かす(恒温器3時間、室温一昼夜程度) |
フィルム時代化石化部分は多々あるが、用語はデジカメでも生き残ってるのがあるので ...フィルム
ASA(ISO)感度フィルムスピード略号 Ex. 25, 1000
数字大なほど速いシャッター可(= 暗所撮影可) カメラ= 一眼レフ + 二眼レフ → 接写には一眼レフ適レンズ↑ < 50 mm = 広角レンズ(同距離からより広い範囲撮影可)50 mm = 標準レンズ(人間の目の画角に最も近い) ↓ > 50 mm = 望遠レンズ (同距離から遠くのものをより大きく撮影可) 撮影倍率= (リング・ベローズの長さ)/(レンズの焦点距離) = AEx. 中間リング50mmを 100mmのレンズに付ける → A = 0.5となるので0.5倍の大きさに写る 露出補正(1 + A)2 = B
Ex. A = 0.5 → B = 2.25
シャッタースピードを1段(1クリック)遅くする、または Ex. ASA100をASA50にセット |
収差≡ レンズにより像に発生する色・像にボケや歪みを生じること色収差: 色づきの歪み ザイデル収差: 像のボケや歪み
球面収差: 入射点の光軸からの距離により集光点の光軸方向の位置が変わるため起こる、光軸上1点から出た光が像面で1点に集束しない収差 デジタル digital camera魚眼レンズ fish-eye lens通常撮影用レンズは、カメラに取り付けると撮影倍率の違いはあるが、基本的には見たままの像を写す→ 周辺に行くほど歪み生じる現象をレンズ組み合わせ補正しているため → 魚眼レンズ: この補正がないレンズ = 上下左右180°の像を写しこむ
種類 ストロボスコープ stroboscopeストロボを連続発光し、動きを「コマおとし」に分解観察する装置ストロボ: 暗い場所に人工的に光を送る装置 カイドナンバー数字大 = 遠くまで光届く(Ex. 40/ASA 100/f2で20 mまで) 高速写真 high-speed photography: ストロボ撮影に必要→ 動物生態調査等に利用される |
|
フィルムカメラでの失敗の少ない撮影 (今じゃ、デジカメ) 機材 一眼レフ + マクロレンズ(なければ接写リング) + あればクローズアップレンズ) できればベローズ 三脚 あればストロボ
植物写真
|
自己満足全ては自分の気に入ったようにセット Ex. 光・影利用
|
菌類水生不完全菌類葉縁を直接顕微鏡観察し分生子柄が葉縁から水中へ伸び出している部分をスパチュラで切り出し、これをスライドグラス上にすくい上げ封入する水酸化カリウム(KOH): 顕微鏡観察時に3-5%溶液を用い、細胞をほぐし、膨張させ見やすくする ドクツルタケでは表面に滴下すると黄変するため試薬として用いる |
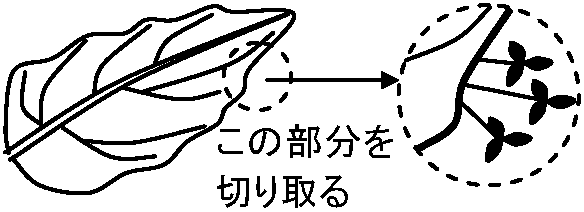 前葉 prophyll: 単子葉類側枝上の第1葉。双子葉類や裸子植物の側枝最基部の2葉
前葉 prophyll: 単子葉類側枝上の第1葉。双子葉類や裸子植物の側枝最基部の2葉
ラクトフェノール(Ex. 石炭酸10 g, 乳酸10 g, グリセリン20 ml, 純水10 ml): 固定・封入 コットンブルー等で染色して封入すると良い
ネイルエナメル: 封縁 |