(2017年3月3日更新) [ 日本語 | English ]
有珠山 / サロベツ泥炭採掘跡
1986年, 2006年の有珠山火口原. ワタスゲ・エゾカンゾウ
ムラサキツユクサ (紫露草)
生活型: 多年生草本
|
分布: 新大陸 (日本では帰化種)
生息地: 日本では都市部に多い
|
北海道で見られたムラサキツユクサ (Tradescantia ohiensis Raf.)
 1
1
 2
2
 3
3
 4
4
[1] 1988年6月18日、札幌市桑園道路沿いにて。[2-4] 2008年8月30日、札幌市東区の未舗装駐車場にて。
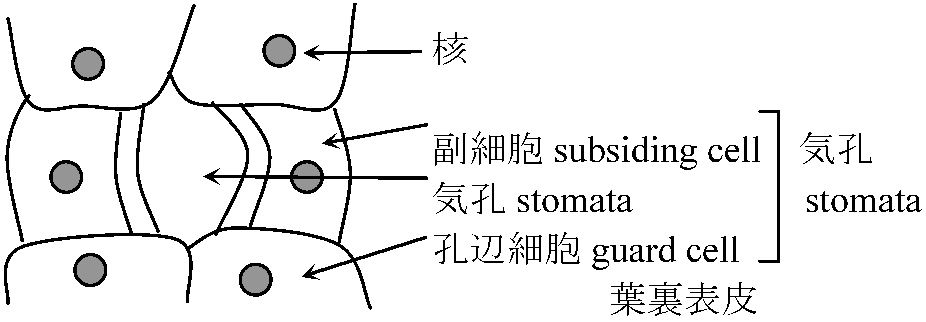
気孔観察 (observation of stoma)
ムラサキツユクサ葉裏の表皮をピンセットで取りプレパラート作成
倍率15 × 20が普通最適
絞りは最も絞った段階で観察
15 × 20では、気孔・細胞壁・細胞膜・核程度は確認可能
より高倍率でも、その他オルガネラ観察は困難
15 × 20でも副細胞では殆どオルガネラが見えない
Cf. Azolla japonica Franchet Sav (オオアカウキクサ, サンショウモ科)
|
|
花粉発芽 (observation of pollen germination)
花粉は普通(自然界では)柱頭上で発芽
人為的誘導可能: 柱頭抽出液、0.3-0.7 M蔗糖液、蔗糖寒天培地等の人工培地上(pH 6.0-6.8)で、適当な湿室中で花粉は発芽し花粉管を伸長させる
花粉発芽プロセス
- 水分により膨潤し原形質流動起る
- 発芽孔から内膜がはみだし管状に伸びる
- 原形質流動などにより核も管に入って行く
- 核や原形質が管先端に移動すると、カロース栓callose plug (仕切り)が形成され原形質を先端に保持して行く
ムラサキツユクサ花粉(pollen)の発芽前後の構造の違いを観察すると共に花粉管生長を測定する
野外: 花粉発芽能力は早朝から数時間しか保持出来ない
= 10時頃で殆ど発芽しなくなる
準備
人工培地調製
- 蔗糖 3 g, 寒天 1 g, 水 50 ml: 混合液をpHをHCl or NaOHで6.2-6.4に合わせる
- コッホ滅菌器(100°C)で15分間加熱
- ペトリ皿に約2 mmの厚さに注ぐ
- 蓋をし放置 = 良く冷ます → 完了(寒天固まる)
実験1
発芽前形態観察
スライドグラスに花粉をまき、酢酸カーミンを一滴加え固定染色
|
カバーグラスを掛け検鏡
スケッチ
ポイント: 生殖核と花粉管核の違い。前者の周りには濃染される細胞質がとりまいている
実験2
花粉管伸長(培地が冷えるのを待って)
- 花粉が出来るだけ散在するように培地上にまく(ゼロタイムとする)
- 顕微鏡接眼レンズにマイクロメーターを組み込む
- 3ケの花粉に注目し、10分毎に花粉管の長さを計る。1-1.5 h測定必要
- 方眼紙に結果をグラフ化してまとめる
記録例: 時間(分) _____ 測定値(長さ) _____
注) 乾燥を防ぐため観察測定は迅速に行う。
実験3
発芽後の形態観察
花粉管伸長が大体プラトーに達した頃、寒天ごと観察した花粉を含む部分を剥ぎとり、スライドグラスに載せる
酢酸カーミンを一滴加えカバーグラスをかける
ガスバーナーでわずかに熱をかけ寒天を溶かす
→ 検鏡
(観察) 花粉管の先端部と核に注目してスケッチ
ポイント: カロース栓、2ケの精核、花粉管核
|
ムラサキオモト (紫万年青)
シキンラン (紫金蘭)
生活型: 常緑多年草
|
原産地: 西インド諸島 - メキシコ
利用: 園芸 (教材)
|
 1
1
 2
2
 3
3
[1-3] 2017年1月24日、北海道大学生物実験センター温室にて
原形質分離 (plasmolysis)
顕微鏡観察 → 細胞浸透価判定
材料: ムラサキオモト
準備: 蔗糖 saccharose (分子量 342.30)、各種ガラス器具
方法
- 原形質分離剤としての蔗糖溶液作成
- 1 M溶液作成: 34.2 gを蒸留水に溶かし全体を100 mlにする(34.2 gを100 mlの水に溶かすのではない!)
- 1 M溶液を希釈し0.1 M, 0.2 M, 0.3 M, 0.4 M, 0.5 M溶液を各20 ml作成しビーカーに入れておく
- オモトの葉の裏表皮をカミソリで薄く削ぎ3 mm位の角に切り多数蒸留水中に沈めておく(切片を扱う際、その中央部分をピンセットでつまむと多数の細胞が壊れるので、端をつまむ)
- 蒸留水中に沈めてあった切片を各モル溶液および蒸留水中に10片位沈める。時間を確認しておく
- 蒸留水中につけてある切片観察。5-10細胞スケッチ(細胞質が紫色に見える良い状態を観察。後同様)。切片は取り出したらスライドグラスに載せ切片の入っていた溶液を1滴かけカバーグラスを軽くかけ顕微鏡下観察。カバーグラス上から圧力をかけてはいけない
- 20-30分後に各モル溶液中の切片を観察しスケッチする。長時間観察すると顕微鏡光源熱でスライド上の水が蒸発し蔗糖濃度が濃くなるので注意!
|
- 各溶液中での細胞が原形質分離を起こしているかいないかを表にまとめる
- 6の結果が+と-あるいは±と-の結果の出た中間濃度溶液を作り再度実験し、その結果から限界原形質分離濃度決定。Ex. 0.2 +/ 0.1 - ⇒ 再実験で0.15で±なら限界濃度は0.125
- 浸透価を計算。モル濃度Cs(限界原形質分離濃度)溶液の浸透圧πはπ = CsRTで近似される
R 気体定数 ≈ 0.082, T: 絶対温度 = 273 + 溶液温度
- 分離を起こした溶液に浸っている切片を蒸留水で洗い、蒸留水をたらしカバーグラスをかけ分離からの復帰を観察する。何分位で戻るか
- カバーグラスはビーカーに入れ、その他のガラス器具は洗浄し、実験開始前の状態に戻す
- レポート完成、提出。実験テーブル及び周辺をきれいにした後退室
表. 原形質分離判断基準(数10個の細胞をみて)
原形質分離細胞比率 得点
75-100% ++
30-75% +
10-30% ±
10% -
|
 1
1
 2
2
 3
3
 4
4

 1
1
 2
2
 3
3