(2014年4月18日更新) [ 日本語 | English ]
HOME > 植物リスト (Plant list) > ユリ科 (Liliaceae)
[ エングラー体系 | 単子葉植物 | 植物分類学 | 参考文献 ]
|
単子葉植物ユリ目(有里ではない) 目-科の区分は見解様々 多系群 ⇒ APG分類体系(科レベルで大幅変更) 200 gen. 3000 spp (s.l., or Engler) 花: 両性(稀単生)、多く放射相称 花被弁: 外3弁 + 内3弁 = 6弁 (2列), 離生-合生 ⇒ 離生花被 apotepalous: 萼と花弁が分化しない花被で離弁に相当する形態 雄蕊: 6 → 葯縦裂普通 子房: (多くは)上位, 3(稀1室), 3個の側膜胎座
生活型: 普通多年生草本(稀蔓生低木)
クロンキスト エングラー体系Liliaceae (ユリ)Xanthorrhoeaceae (ススキノキ) Stemonaceae (ビャクブ) Agavaceae (リュウゼツラン) Haemodoraceae Cyanastraceae Amaryllidaceae (ヒガンバナ) Hypoxidaceae (キンバイザサ) Velloziaceae Taccaceae (タシロイモ) Dioscoreaceae (ヤマノイモ) Pontederiaceae (ミズアオイ) Iridaceae (アヤメ) Geosiridaceae Burmanniaceae (ヒナノシャクジョウ) Corsiaceae Philydraceae (タヌキアヤメ) |
ダルグレン APGCorsiaceae (コルシア)Campynemataceae (カンピネマ) Melanthiaceae (シュロソウ) Petermanniaceae (ペテルマニア) Colchicaceae (イヌサフラン) Alstroemeriaceae (Luzuriagaceae含) (ユリズイセン) Rhipogonaceae (リポゴヌム) Philesiaceae (フィレシア) Smilacaceae (サルトリイバラ) Liliaceae (ユリ) 科の検索(日本)1. 子房下位 ovary inferior2. 雄蕊6 (6 stamens)、葯外向きでない。葉跨状でない 3. 花両性。茎蔓にならない
4 葉分裂しない。子房3室 ___ Amaryllidaceae ヒガンバナ 2 雄蕊3 (3 stamens)、葯は外向き。葉は跨状 ___ Iridaceae アヤメ 1 子房上位 ovary superior
2 花被片鱗片状 ___ Juncaceae イグサ
3 花3数性trimerous (稀2数性)。子房3-2室 ___ Liliaceae + Asparagales キジカクシ(アスパラガス) + Xanthorrhoeales ススキノキ |
|
Melanthoideae シュロソウ亜科 (Melanthiaceaeとし独立)
Chionographis Maxim. シライトソウ Herreriopsis H. Perrir: マダガスカル Asphodeloideae ツルボラン亜科 (Asphodelaceaeとし独立)
Aloe L. アロエ Lilliodeae ユリ亜科
Amana Honda アマナ |
Alstoroemerioideae アルストロエメリア亜科(Alstoroemeriaceaeとし独立) Scilloideae ツルボ亜科 (Scillaceaeとし独立) Scilla ツルボ Allioideae ネギ亜科 Asparagioideae キジカクシ亜科
Asparagus L.キジカクシ Ophiopogon Ker-Gawl.ジャノヒゲ Luzuriagoideaeルズリアガ亜科 (Philesiaceae, Petermanniaceaeとする見解)Cf. 亜科位置調べる: Narthecium asiaticum キンコウカ - 道EN |
|
7(8)種 1 花萼片のみ。萼片鈍頭、長さ12-20 mm _____ エンレイソウ 1 花萼片と花弁。萼片長20-35 mm。葯6-15 mm。子房円錐状卵形
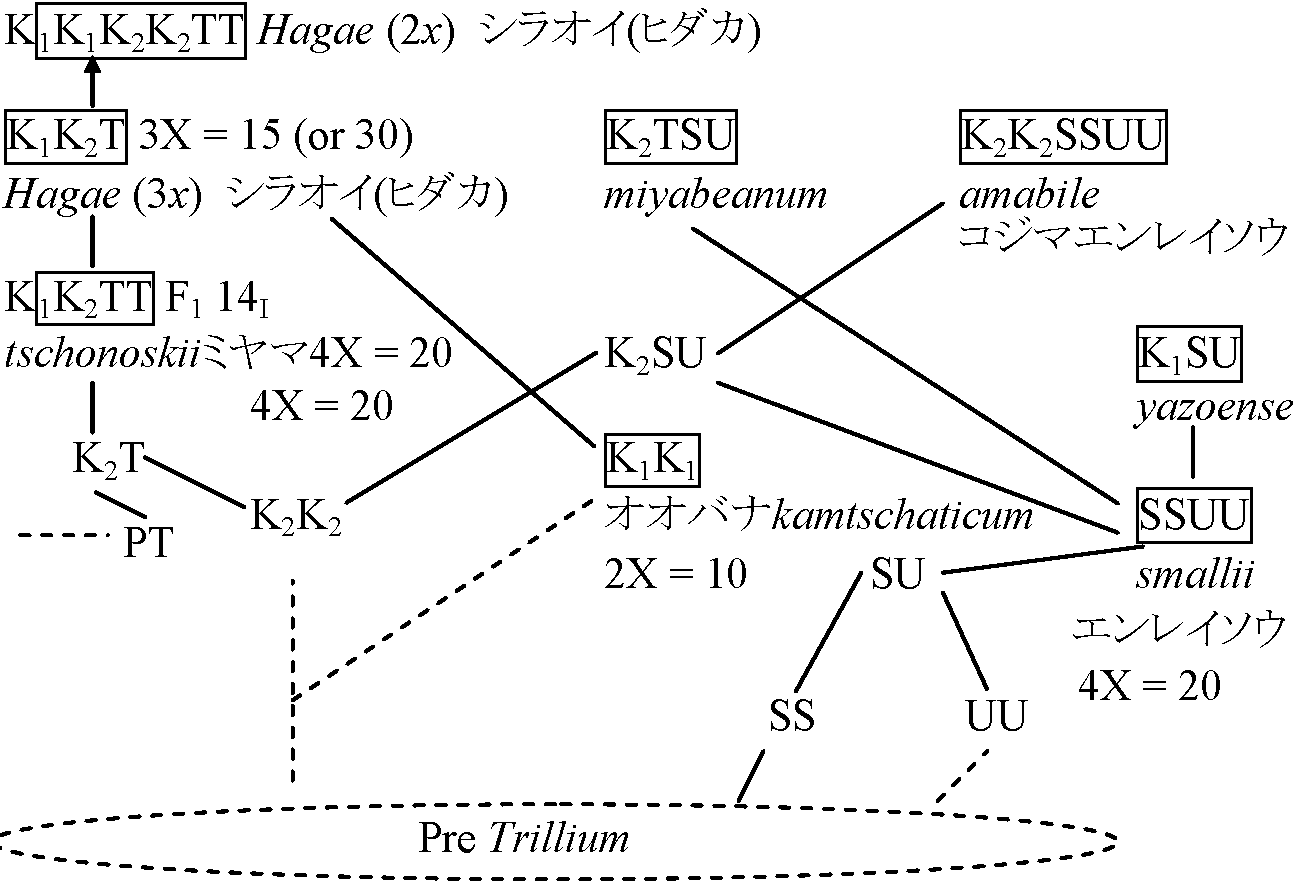
2 萼片花弁鋭頭12-27 mm l。葯長さ6-7 mm。花柄2-3 cm _____ シロバナエンレイソウ(= ミヤマエンレイソウ) T. smallii Maxim.(non. T. apetalon Makino) エンレイソウ: 地下茎太く地下這う丈夫な根。茎: 高さ20-40 cm, 円く無毛 T. amabile Miyabe et Tatewaki コジマエンレイソウ = エンレイソウ × オオバナ: エンレイソウに似るが紫色花弁-より発達。花弁広卵形 T. × miyabeanum Tatewaki ヒダカエンレイソウ = シロバナ × エンレイソウ: コジマに比べ萼片先端鋭い。子房卵形。雄蕊は雌蕊と同長か長い T. × hagae Miyabe et Tatewaki シラオイエンレイソウ = シロバナ × オオバナ: 花が横を向く、大型(高さ20-50 cm)染色体遺伝学染色体基本数= 5 ⇒ 全て倍数関係実験: 染色体低温処理 - Feulgen negative region - ゲノム分析 - 類縁関係は次の様に明らか (Kurabayashi & Saho 1957)
|
|
[APG: Asphodelaceae (ワスレグサ)]
|
利用: 食用(蕾・花, 金針菜) H. fulva L. var. fluva (ホンカンゾウ) var. kwanso Regel (ヤブカンゾウ) var. littorea (Makino) M. Hotta (syn. H. littorea Makino) (ハマカンゾウ) var. longituba (Miq.) Maxim. (syn. H. longituba Miq.) (ノカンゾウ) |
|
[ 栽培 ]
|
1. 花 > 10 cm l。夜間に開花し芳香ある。雄花は花被基部に合生 ___ H. plantaginea (ギボウシ) 1. 花 < 5 cm l。朝か昼間に開花し芳香ない。雄蕊は花被基部と離生 2. 葉狭く長楕円状披針形-長楕円状卵形、基部は葉柄に流れる。花茎直立し苞舟形、花冠多くは濃紫色
3. 花茎には普通の葉が多くつき苞も葉状、花柄短く8-12 mm ___ H. undulata (スジギボウシ) 4. 苞舟形で、蕾時は重なり開花の時も立つ
5. 葉縁は黄色、葉は根際から水平に開出する ___ ニシキギボウシ 6. 花冠の筒狭部は筒広部より短い
7. 葉鋭頭-鋭尖頭。葉身は葉柄に次第に移行する ___ H. rectifolia (タチギボウシ) 6. 花冠の筒狭部は筒広部と同長
7. 葉狭披針形で立ち、光沢があり、花小さく少ない ___ ミズギボウシ 8. 葉は水平に開出。苞は自身で巻く ___ ハカマギボウシ
9. 全体大きく、花茎80-120 cm、葉30-40 cm ___ オモトギボウシ 4. 苞は扁平で、蕾の時は開出し星状となる 5. 全体大きく、花茎45-70 cm、葉30-45 cm
6. 葉狭卵形、苞残る ___ ナンカイギボウシ 5. 全体より小さく、花茎20-30 cm、葉10-15 cm
6. 花被片披針形 ___ ヒメイワギボウシ 2. 葉広く卵形-広卵形、基部は心形-円形または切形、葉柄に流れない(稀に狭く流れる) |
3. 花冠筒広部ほぼ直角に広がりコップ状となる ___ ムラサキギボウシ 4. 苞は舟形、広楕円形、長さ2 cm、やや厚い。花茎に筋がある。花穂は短く花が集まる
5. 葉1-2枚、葉身大きく20-40 cm、裏面緑白、花間はやや離れる ___ ウラジロギボウシ 4. 苞扁平、花筒狭部に溝なく、筒広部透明線は不明
5. 苞0.7-1.2 cm、白紫色で薄膜質、花後に腐る。花9-10月、葉9-13 cm ___ イワギボウシ 6. 苞最下片長く長鋭尖頭、その2片は蕾時内に花序を抱き円錐体作る
7. 花茎は下へ曲がって垂れる ___ ウナズキギボウシ 6. 苞短く覆瓦様になる
7. 筒広部急に広がり、花冠裂片反り返る ___ ラッパギボウシ 6. 苞短く扁平で、蕾時星状に展開し、しばしば帯白色。花被は質厚い
7. 葉質硬く厚く平たいか舟状、初め白粉ある。花茎高く、花糸太い。下面側脈は隆起せず脈状突起ない ___ ラッパギボウシ 8. 花茎は葉叢より短いか少し高い。葉は碧緑白色、筒の広部は円錐形
9. 葉大きく葉身20-25 cm、広楕円形。栽培 ___ H. sieboldiana (トウギボウシ) 8. 花茎は葉叢より著しく長い。葉緑色。筒広部狭円錐形
9. 葉身15-30 cmで有長柄 ___ H. sieboldiana (オオバギボウシ) |
|
1. 外花被片白色, n = 8。葉 20-30 cm l。地下茎は太い ___ キヌガサソウ P. japonica 1. 外花被片緑色。葉 ≈ 10 cm l |
2. 葉は普通8。内花被片糸状。葯壁長く伸びる ___ クルマバツクバネソウ P. verticillata |
|
= ニシキユリ(錦百合) 短日植物 地中海東部沿岸原産: 1863年に日本移入 花: 野生種 = 青紫色 - 園芸種 = 多様(青紫、白、ピンク、赤、橙、黄色他) |
蒴果: 卵円形 鱗茎: 卵形 H. orientalis var. albulus (ローマンヒアシンス): 疎らな小さめの花 |
[APG III: キジカクシ/クサスギカズラ科]
|
世界3種 日本2種 M. dilatatum (マイヅルソウ) 毛: 無毛 |
M. bifolium (L.) F. W. Schmidt (ヒメマイヅルソウ)
毛: 葉裏・葉柄に軟毛 |
北半球96種 (日本15種)
園芸品種Asiatic hybrid (Lilium × elegans) 親は主に橙色カロチノイド色素持つ: アジア原産親(L. dauricum, L. maculatum, L. callosum, L. pumilum, L. cernuum, L. lancifolium 等)を中心に交配 Oriental hybrid 日本産ユリ: 親 = L. auratum, L. speciosum、タモトユリ等 - 森林性 Longiflorum hybrid テッポウユリ群: 親 = L. formosanum, L. longiflorum Martagon hybrid (マルタゴン): 親 = L. martagon, L. hansonii, L. medeoloides等 Trumpet hybrid: 親 = 中国原産 L. henryi, L. regale (regal lily), L. brownii var. viridulum等 その他 食用ユリ (作物)大半を北海道で生産
アイヌが珠芽を食用とした |

 Table Dance 
 Tiny Goast |

 Lollipop 
 Ceb Dazzle |
(大学3年時 実験ノート)
ユリ科植物
|
|
花粉母細胞減数分裂⇒ meiosis of pollen mother cells減数分裂中期染色体構造と金属イオン減数分裂の中期染色体構造に及ぼす金属イオンの影響 (R.D of pollen mother cells on Trillium)実験材料と方法 (これまでソラマメ(Vicia faba)根端細胞観察実験に基づき体細胞分裂過程を把握) ついで、減数分裂過程を理解する。また、その過程中に金属イオンを投与しその結果を考察する 準備: メスシリンダー・ピペット・ビーカー・メス・スライドグラス・カバーグラス・ピンセット・割箸・ロウ・へら・スパチュラ・濾紙・酢酸カーミン・Kcl・NaCl・CaCl2・KNO3 手順
|
X線による細胞分裂異常: 特に染色体異常誘発目的Trillium属の核型を観察し karyotype を決定する。ゲノム解析 genome analysis の基礎を知る。材料にX線照射を行い予想される染色体異常を観察する。染色体構造変化を目的としたX線を用いた染色体異常誘発結果を観察するI. X線(電離放射線)による異常細胞分裂異常
spindle fiber異常 → 遅滞染色体lagging chromosomes 体細胞ではG1-S期照射は染色体異常、S-G2-M期照射は染色分体異常、M期前期照射は半染色分体異常が生じた。減数分裂では第1分裂前期太糸期-中期照射時に半染色分体異常を生ずるのが特異的である II. 実験材料と方法材料: Trillium kamtschaticum Pallの胚珠壁細胞(ovular tissure cells)方法: ovaryにx1 r, x2 r, x3 rのX線照射 (x r/min; Kv, mA; mm Cu + mm Al) = ここでは20R, 40R, 80R 固定・染色: 照射後、24h, 48h, 72hで固定する
Fixation (LaCour 2BE fixative使用なら20 min.) III. 観察
|
Trillium染色体の euchromatic segments と heterochromatic segments 観察
Trillium属にみられる倍数体の染色体観察方法: Trillium数種のovular tissue cells染色体を"X線染色体異常"の項の方法で固定染色しsquash methodでプレパラート作製準備: ビーカ・メスシリンダ・細口試薬ビン・冷却器・分液漏斗・温度計・ピペット・濾紙・薬包紙・45% acetic acid・basic fuchsin・1N HCl・無水異性重亜硫酸カリ・活性炭・1% クロム酸カリ・5% acetic acid・サポニン・2% osmic acid・恒温槽・管ビン・ガーゼ・カミソリ・輪ゴム・slide glass・ピンセット・割箸・ロウ・ヘラ 材料: Genus Trillium (T. apetalon, T. tschonoskii, T. hagae, T. miyabenum, T. kamtschaticum) - these ovaries 操作A. Observation of karyotype
|
シッフ試薬(Schiff's reagent)作成法アルデヒド検出試薬 (= フクシンアルデヒド試薬)シッフ反応 (Schiff’s reaction): アルデヒド存在下で2分子アルデヒドR(O=)CHと1分子Schiff's fluidが反応し赤紫色化合物生成 Basic fuchsin (1 g) + 200 ml boiled water↓ 良く溶かす ↓ 50°Cまで冷やす 20 mlの1N HClを加える [= 1N HCl: specifi gravity = 1.19のconc. HCl 82.5 mlを水で1 lにする] ↓ 25°Cまで冷やす ↓ 無水異性重亜硫酸カリ3 gを加える(別名ピロ亜硫酸カリK2S2O5) [← 無水亜硫酸ソーダNa2SO3代用可] 冷暗所に24hr以上置く(黄色となる) |