(2016年9月11日更新) [ 日本語 | English ]
HOME > 講義・実習・演習一覧 / 研究概要 > 小辞典 > ウィルス
|
代謝を宿主細胞に完全依存 = 宿主中でのみ増殖 メガウイルス発見 = 細菌に近縁 → 遺伝子の大部分を捨て去り寄生に進化 レトロウイルス = トランスポゾンと類似性 → 機能性核酸が独立・進化 ウィルス群 多系進化? → 結果として人為分類群 細菌濾過器通過病原体 (pathogen)の総称。300種以上。大きさ: 10-450 μm昔はウィルスが宿主に発現させた時点でウィルス存在を認めた → 特定の病気を特定ウィルスが起こすと考えていた 幾つかの潜在性ウィルス(EMレベルでタンパク質・核酸確認)が知られる
Ex. TMV (tobacco [=host] mosaic [= desease] virus): 種類数は増える 特性単独で生命活動できない(物質交代機能失っている) → 無生物的生物(寄主)細胞内では盛んに自己複製により増殖 → 生物的 核タンパク質、核酸部分: 植物寄生 = RNA、細菌 = DNA, 動物 = DNA/RNA ウィルス核酸は遺伝子の役割がある: X線で突然変異、交雑により組合わせ変える 無生物 → 生物 → [二次的に生物的特徴を失う] → ウィルス: 微生物が退化し核酸のみが残ったもの |
ウィルスRNA (RNA in virus)Ex. TMV 植物ウィルス。RNA, タンパク質のみからなる。RNAとタンパク質を分離しタバコ葉に塗るとRNAを塗ったときのみウィルス粒子形成 → RNAは遺伝子として機能 ウィルスの構造形成
ウィルスは細菌に侵入すると細菌DNAの働きを停止させ、virus DNAの働きをさせる。Virus DNAの作用により新しいウィルスを構成する各部分が作られ、各部分は作られた後に「自動的に結合」して完全なウィルスになる 植物ウィルス: モザイクウィルス、萎縮病ウィルス 動物ウィルス: 天然痘、狂犬病、麻疹、ポリオ 細菌ウィルス(バクテリオファージ bacteriophage): T系ファージ(大腸菌寄生) アルファルファウィルス alfalfa virus、衛星ウィルス satellite virus(ex. TMV)、ウイロイド viroid (核酸のみで被覆タンパク質なし) → Lwoffの定義では必ずしもウィルスとは言えない |
|
ウィルスに種は存在するのか? ウィルス分類大系はあるのか? 二名法必要性の議論: 分類上の問題ではない
動物ウィルス: 宿主範囲 (host range)未詳のもの多 タンパク質による種(protein species)とは異なる → 表現型(形態)による分類をせざるをえない ウイルス分類: 現時点は階層的 = リンネ分類大系と全く異なる Ex. 分類第一基準 = 核酸性質(DNA or RNA) 高等生物分類大系修正でウイルス分類もリンネ分類大系で可能 = 種名は慣用名で十分(四方 1984)3分類概念
国際ウイルス分類委員会= International Committee on Taxonomy of Viruses, ICTVボルティモア分類 (Baltimore classification): ウィルス核酸型と発現形式に重点 (Baltimore 1971) |
|
|
表現型 (phenotype): ゲノムサイズgenome size → [認識] → 外部形態: 表現型による分類様式の有用性 形態 (morphology): 外部構造, 微細構造 ? 共にEM発達により可能となる。光学顕微鏡解像度は理論上 > 0.2 μm ウイルス研究に寄与した技術
構造単位ビリオン (viron) = ウィルス粒子ヌクレオカプシド (nucleocapsid): ゲノムとキャプシドの複合体 |
カプソメア (capsomere) = 形態単位 → 種により一定 キャプシド (subunit or capsid) = タンパク質構造単位 エンベロープ (envelope): ウィルス表面を覆う膜 → 種により有無 球形ウィルス (Spherical virus)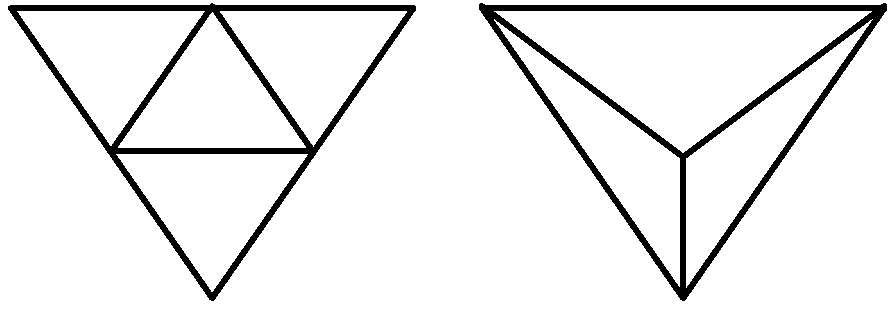 T = 1 × 2² = 4 立ち上がる T = 3 × 1² = 3
T: 三角形分割数 triangulation number 対称性問題 (ペンタマー、ヘキサマー)
n回転対称
これら粒子配列を用い分類する試みがある
5回転
3回転
2回転 球形ウイルス = 正20面体 基本 P = 1 (f = 1, T = 1), or 3 (f = 1, T = 3)
A: 5-5 (p = 1, f = 1, M = 12) |
特徴
ウイルス 分子量 沈降 RNA タン その他 係数 (DNA) バク 106 Dt S20,w % 質 % RNAウイルス タバコモザイク 39.4 194 5 95 微量の金属とポリアミン ジャガイモX 35 118 6 94 カーネーション潜在 60 167 6 94 ジャガイモY 70 145 5 95 ビート萎黄 86 130 5 95 オオムギ yellow dwarf 117 タバコネクローシス 7 118 19 80 タバコネクローシス付随 2 50 20 80 トマトbushy stunt 9.3 140 17 83 カブ黄斑モザイクB成分 5.4 117 34 60 0.7%ポリアミン カブ黄斑モザイクT伐分 3.6 54 0 100 レタスnecrotic yellows 1000- 940 < 1 脂質、炭水化物 1400 DNAウイルス ハナヤサイモザイク 28 220 (16) 84 表3.3 ウイルス核酸の分子量と塩基組成(単一ゲノムを有するウイルス) 分子量 沈降係数 塩基組成 (モル比) ウイルス 106 Dt S20, w G A C U RNAウイルス タバコモザイク 2.05 30 (0.1 M PO4) 25.3 29.8 18.5 26.3 ジャガイモX 2.1 22 32 24 22 カーネーション潜在 31 24 23 22 ジャガイモY 3.5 28-34 24-27 17-21 21-28 ビート萎黄 4.6 28 27 22 23 オオムギ yellow dwarf 2.0 33 タバコネクローシス 1.5 27 (0.1 M NaCl) 24 26 22 28 タバコネクローシス・付随 0.4 14 (0.1 M PO4) 23 28 21 28 トマト bushy stunt 1.5 27 28 25 22 25 カブ黄斑モザイク(B成分) 1.9 2.18 (0.01 M Tris) 27.2 22.4 38.3 22.1 レタス necrotic yellows 4 43 DNAウイルス ハナヤサイモザイク(CAMV) 4.7 20 (2本鎖DNA) G + C = 43% 多粒子性と分節ゲノム植物ウイルスに限る植物ウイルスは圧倒的にRNAウイルスが多い → DsDNA: ハナヤサイ = 16% nucleic acids。ssDNAも見つかる 分節ゲノム: ウイルスゲノムが複数個に分布している
ショ糖密度勾配法により分節ゲノムを分ける a) 多粒子性分節ゲノム
b) 1粒性分節ゲノムEx. wound tumor virus: 全て均一のゲノムサイズ(dsRNA)のもの12対で構成
= (分節ゲノム分子量 × ウイスル塩基対の平均分子量 × 3) 分節ゲノムの各ゲノムは異なる遺伝子が乗っているが、CMVの#5 genomeのようになくてもCMVそのものが増えることは可能。#5には壊疽遺伝子が乗っていた。分節ゲノムの方がゲノムサイズが1のものより1つのゲノムあたりで乗っている遺伝子が少なく性質を解析しやすい。 |
ゲノム情報発現情報発現形質因子が核酸であることを示した古典的なウイルス情報発現機構研究が核酸研究に寄与しているEx. T4 phageの成分のうち核酸しかバクテリアには入らない Ex. TMPを用いた感染実験 (1955)
▇▇▇▇▇▇▇ 核酸 ━━━━━━━━━━━> タバコ - (病徴なし) Extracted NA → タバコ (+)わずか、粒子を与えたときの1/1000程度発現 ほぼ同時に2論文でる。両者の違いはウイルスのタンパク質核酸分離方法であった。それまでの実験の問題は核酸中にタンパク質痕跡trace proteinが存在しないことを証明できなかったことであるEx. 上記の抽出核酸をRNaseを用いて分解すると病症は発現しない
Plant virus m-RNA synthesis cycleRNA → mRNA過程重要 [+RNA: transformation可能 / -RNA: transformation不可能]+RNAは、RNA → mRNA過程の必要酵素を持つはず。+RNA virusはそのNAだけ宿主に入ればよい -RNA virusは、そのNAだけでは増殖できないが、粒子で宿主に入ると増殖できる。つまり、ウイスルタンパク質上に既に-RNA → +RNAのための酵素が乗っていると考えられる ±RNA (= dsDNA): 2重鎖であるが高等生物の2重鎖とは構造が異なる Ex. イネ萎縮ウイルス dsDNA
ウイルスでも遺伝子調節(制御)ができる – Cf. 植物の全能性(組織培養) Ex. Ono (1984)
多粒子性ウイルスの粒子成分間相互作用を示す相互補完型: Ex. TRV。長粒子はRNA複製酵素の、短粒子は外被タンパク質の遺伝子を持ち、同時感染によりウイルス粒子形成 相互依存型: Ex. CpMV。下層成分と中層成分は、それぞれRNA複製酵素と外被タンパク質の遺伝子を持ち、同時感染しなければウイルスRNA複製は起こらない 自律増殖能欠損型 Ex. TNV-STNV。自己複製酵素と外被タンパク質の遺伝子を持ち自律的増殖可能だが、さらに付随ウイルスRNA複製にも関与する。したがって、TNV単独感染によってSTNV-RNAが複製されることになる。STNV-RNAはmRNAとなって、自己の外被タンパク質を作る 表4.3 多粒子性ウイルスにおけるウイルス核酸の情報分担 TMV-stNVの関係: 生物学的現象解析より判明(sTNV形成意義不明)。ウイルス系統発生に関係したものという説がある。Ex. ウイロイドは真核生物イントロン部分塩基配列に似ていることから、真核生物から発生(進化)したものではないかと? これは従来のウイロイドからウイルスへの発生ラインの説と大きく異なる。 |
| 相互作用の様式 | ウイルス | RNA | RNA分子 106 Dt | 情報 |
| 相互補間型 | タバコ茎壊疽(TRV) | L-RNA | 2.3 | RNA複製、病徴 |
| S-RNA | 0.6-1.3 | 外被タンパク質、病徴 | ||
| 相互依存型 | カウピーモザイク(CpMV) | B-RNA M-RNA | 2.6 1.5 | RNA複製,外被タンパク質、病徴 RNA複製、外被タンパク質、病徴 |
| プロムモザイク(BMV) | RNA-1 RNA-2 RNA-3 RNA-4 | 1.09 0.99 0.75 0.28 | RNA複製 RNA複製、病徴 RNA複製?、外被タンパク質, 病徴 外被タンパク質 | |
| B-RNA | 1.27 | RNA複製 | ||
| アルファルファモザイク(AMV) | M-RNA Tb-RNA | 1.00 0.76 | RNA複製、病徴 RNA複製?, 外被タンパク質, 血清型, 病徴 | |
| Ta-RNA | 0.33 | 外被タンパク質 | ||
| 自律増殖能欠損型 | タバコネクローシスー付随(TNV-STNV) | TNV-RNA | 1.5 | RNA複製(TNV,STNV両粒子)、外被タンパク質(TNV粒子)、病徴 |
| STNV-RNA | 0.4 | 外被タンパク質(STNV粒子) |
| ウイルス | 分節ゲノム数 | 分子量 106 Dt | 沈降係数 S20, w | 塩基組成 | (モル比) | ||
| G | A | C | U | ||||
| タバコ茎えそ | 2 | 2.3 (L) | 26 (0.01 M tris) | 25 | 29 | 17 | 29 |
| 0.6-1.3 (S) | |||||||
| ムギ斑葉モザイク | 3 | 1.4 (L) | |||||
| 1.25 (M) | 20 (0.1 M NaCl) | 20.3 | 30.9 | 19.4 | 29.4• | ||
| 1.15 (S) | |||||||
| カウピーモザイク | 2 | 2.6 (B) | 34 | 22.9 | 28.5 | 17.2 | 31.4 |
| 1.5 (M) | 26 | 28.4 | 28.4 | 19.3 | 31.6 | ||
| タバコstreak | 4 | 1.3 (B?) | |||||
| 0.8 + 0.4 (M?) | |||||||
| 1.1 (T?) | |||||||
| タバコ輸点 | 2 | 2.3 (B) | 32 | ||||
| 1.2 (M) | 24 | 26 | 23 | 22 | 29 | ||
| エンドウenationモザイク | 2 | 1.7 (B) | 29 | 26 | 24 | 24 | 26 |
| 1.4(T) | 26 | ||||||
| アルファルファモザイク | 5 | 1.27(B) | 24 | 23 | 27 | 21 | 30 |
| 1.0 (M) | 22 | ||||||
| 0.76 (Tb) | 20 | ||||||
| 2 × 0.33 (Ta) | 13 | 24 | 25 | 23 | 28 | ||
| ブロムモザイク | 4 | 1.09(H) | 27 | 28 | 27 | 21 | 24 |
| 0.75 + 0.28(M) | 14 + ? | ||||||
| 0.99(L) | 22 | ||||||
| キュウリモザイク | 5 | 1.07(H) | 23 | 23.4 | 24.3 | 23.2 | 29.1 |
| 0.69 + 0.33(M) | 20? | ||||||
| 0.95 + 0.11(L) | 13+? | ||||||
| トマト黄化えそ(TSWV) | 4 | Σ7.4 | 38 | 35 | 9 | 18 | |
| Wound tumor | 12 | Σ16.6 | G + C | = 38% |
粒子成分の頭文字を示す。裏3.2参照。ただし、ブロムモザイクウイルスとキュウリモザイクウイルスの(H), (M), (L)は密度粒子成分の頭文字で、Heavy, Medium, Lightを示す。
| ウイルス | 沈降粒子成分 | 分子量106 Dt | 沈降係数 | RNA% | タンパク質% | その他 |
| タバコ茎えそ | L (Long) | 50 | 300 | 5 | 95 | - |
| S (Short) | 12-29 | 155-243 | 5 | 95 | - | |
| ムギ斑葉モザイク | L | 200 | 4 | 96 | - | |
| M | 26 | 185 | 4 | 96 | - | |
| S | 178 | 4 | 96 | |||
| カウビーモザイク | B (Bottom) | 7.7 | 115 | 33 | 67 | - |
| M (Middle) | 6 | 95 | 24 | 76 | - | |
| T (Top) | 4.6 | 58 | 0 | 100 | ||
| タバコ streak | B | 113 | 14 | 86 | ||
| M | 96 | 14 | 86 | - | ||
| T | 84 | 14 | 86 | - | ||
| タバコ輪点 | B | 5.7 | 126 | 43 | 57 | - |
| M | 4.9 | 91 | 27 | 73 | - | |
| T | 3.3 | 53 | 0 | 100 | - | |
| エンドウ enation モザイク | B | 5.3 | 120 | 28 | 72 | - |
| T | 4.4 | 100 | 28 | 72 | - | |
| アルファルファモザイク | B | 7.3 | 9 | 18 | 82 | - |
| M | 89 | 18 | 82 | - | ||
| Tb | 75 | 18 | 82 | - | ||
| Ta | 3.7 | 68 | 18 | 82 | - | |
| To | 60 | |||||
| ブロムモザイク | - | 4.6 | 87 | 22 | 78 | - |
| キュウリモザイク | - | 5.8-6.7 | 98 | 18 | 82 | 10%脂賃 7%炭水化物 |
| トマト黄化えそ | - | 560 | 5 | |||
| Wound tumor | - | 70 | 514 | 22 | 78 | - |
TMVの構造 (structure of TMV)Ex. TMV: 比較的明瞭な制御regulationがある
[再構成開始部位] ⇓ 全長の13% 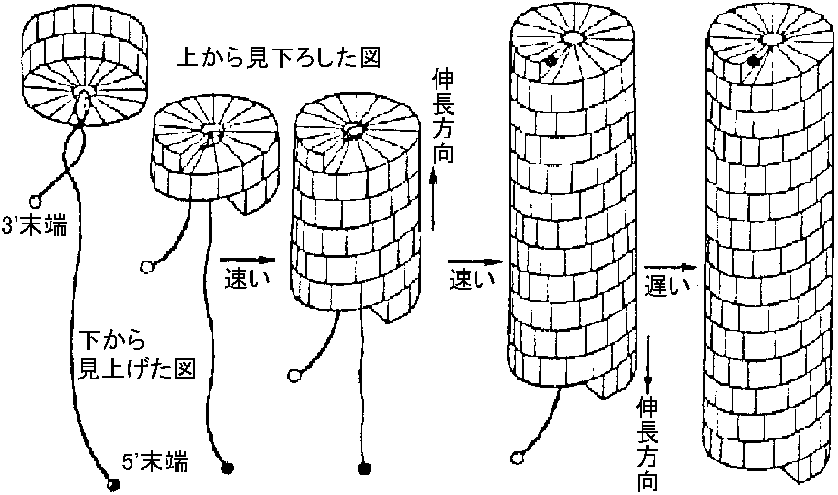
図. TMV形態形成モデル |
ウイルスはタンパク質識別できる → TMVタンパク質サブユニットで作った初期複合体は、同種タンパク質サブユニットのみと集合する。初期複合体にCGMMV-スイカ系統タンパク質サブユニットを反応させるとTMV-RNAとCGMMV-タンパク質間で相互作用が見られる。これは、CGMMVタンパク質サブユニット一次構造にTMVのと共通した認識部位があるためである。しかし、初期複合体のTMVタンパク質とCGMMVタンパク質間では異種タンパク質として識別され粒子の積み重ねが起こらない ベクターが昆虫のウイルスでも組織培養細胞では感染可能。昆虫中で増えるウイスルの分節ゲノム中で外層outer layer消失型がある。一方、昆虫中で増殖することから、この型のウイルスは本来昆虫ウイルスであるという仮説がある。さらに、CAP構造を比較すると、昆虫媒介ウイルスの構造は動物ウイルスのものに近い |
|
病状の発現: 作物種類、品種 外囲条件: 宿主 → 感染性の差、媒介虫の発生 → 状況 表. ウイルスの感染対象(植物) Incidence of viruses in different phyla. Number of species with which viruses are known to be associated: - none, + 1-10 species, ++ 10-100 species, +++ more than 100 species. 系統 phylum 感染する 媒介者として作用する Number of species that are infected can act as vectors 1 細菌, +++ - バクテリオファージ, マイコプラズマウィルス 2 藍藻ウイルス +++ - 3 緑虫植物 + - 4 褐藻類 + - 5 紅藻類 + - 6 真菌類a ++ + 7 緑藻類b + - 8 車軸藻類 + - 9 羊歯類c + - 10 種子植物 +++ + a: 菌ウィルス mycovirus - 菌類感染ウイルスは全てds DNA。乾燥後に摂食できるキノコはシイタケのみ → ウイルス感染で小型化. b: Ex. クロレラウイルス(4種). c: Ex. ゼンマイ、ワラビ,タマシダ |
ウイルスの診断
変異種の特徴と分類タンパク質コートのアミノ酸組成は異なるEx. TMV-RNA 160 K 再構成開始部位17 K ----░░░░░░░░░░░----░░░░█░░----░░░░░--- 分類
|
| ウイルス名 | 指標植物 | 発現まで日数 | 指標植物上の病徴 |
|---|---|---|---|
| Xウイルス | センニチソウ シロバナヨウシュチョウセンアサガオ タバコ(ホワイト・バレー) トウガラシ | 4-7 5-10 5-10 5-10 | 灰白色小斑点 → 斑点周囲赤紫色 → 黄変枯死 ↓ 褐色 → 葉脈周辺濃緑, 脈間褪緑のモザイク ↑ 強系統は褐色壊疽 黒褐色の壊疽斑点 |
| Yウイルス | シルベストリス・タバコ 馬鈴薯(農林1号) | ≈ 10 7-10 | 新葉の脈透明, 網目状症状後葉脈緑帯 接種葉に黒褐色えそ(1-2 mm)斑点, 脈に壊疽 |
| Fウイルス | グルチノーサ・タバコ トウガラシ | 7-10 5-10 | 新葉に鮮黄色かすり模様 接種葉に灰白色小斑点 → 周辺濃褐色 → 接種葉枯死 |
| Mウイルス | デブネイ・タバコ ササゲ | ≈ 15 ≈ 10 | 輪状局部病徴 斑点または縞紋状褐色病斑 |
| Sウイルス | デブネイ・タバコ | 18-20 | 上葉葉脈透明 → モザイク → 壊疽 |
| Aウイルス | 馬鈴薯(ソラナム・デミッサムA6) フイザリス・フロリダーナ | 3-5 ≈ 7 | 褐色局部壊疽,Yウイルスより病斑小 褐色局部病斑 |
| アルファルファ・モザイク・ウイルス | インゲン フイザリス・フロリダーナ | ≈ 5 7-10 | 局部病斑 上葉に黄白色斑紋 |
| 番号 | ウイルス名 | 媒介者(host = vector) | ウイルス形 | ウイルス大きさ (μm) | |
| 1 | カモジグサモザイクウイルス ホソムギモザイクウイルス コムギスジモザイクウイルス | ダニ ダニ ダニ | ひも ひも ひも | 717 × 19 703 × 19 706 × 19 | |
| 2 | Potyvirus | ジャガイモYウイルス インケンモザイクウイルス インゲン黄斑モザイクウィルス アズキモザイクウイルス | アブラムシ アブラムシ アブラムシ アブラムシ | ひも ひも ひも ひも | 730 × 11 750 × 15 750 × 12 710 × 13 |
| 3 | Carlavirus | ジャガイモSウイルス カーネーションモザイクウイルス | アブラムシ アブラムシ | ひも ひも | 660 × 13 675 × 13 |
| 4 | Closterovirus | テンサイ萎黄.ウイルス カンギッドリステザウイルス | アブラムシ アブラムシ | ひも ひも | 1,250 × 12 2,000 × 12 |
| 5 | キュウリモザイクウイルス | アブラムシ | 小球 | 30 | |
| 6 | アルファルブナモザイクウイルス | アブラムシ | 楕円 | 58 × 18 | |
| 7 | エンドウヒダ葉モザイクウイルス | アブラムシ | 小球 | 30 | |
| 8 | Letrovirus (16) | ジャガイモ葉巻ウイルス オオムギ黄化萎縮ウイルス テンサイ西郡萎黄ウイルス ダイズ頬化ウイルス | アブラムシ アブラムシ アブラムシ アブラムシ | 小球 小球 小球 小球 | 25 24 25 25 |
| 9 | レタス necrotic yellows ウイルス ノゲシyellow veinウイルス | アブラムシ アブラムシ | 長楕円 長楕円 | 227 × 66 220 × 80 | |
| 10 | Caulimovirus | ハナヤサイモザイクウイルス ダリアモザイクウイルス | アブラムシ アブラムシ | 大球 大球 | 50 50 |
| 11 | Plant reovirus | クローバー腫瘍ウイルス イネ萎縮.ウイルス イネ黒条萎縮ウイルス | ヨコバイ ヨコバイ ウンカ | 大球 大球 大球 | 60 75 60 |
| 12 | イネ縞葉枯ウイルス | ウンカ | 小球 | 30 | |
| 13 | イネhoja-blancaウイルス | ウンカ | ひも | - | |
| 14 | Rhabdovirus (9) | ジャガイモ黄化萎縮ウイルス トウモロコシモザイクウイルス ムギ類北地モザイタウイ々ス イネ黄葉ウイルス | ヨコバイ ヨコバイ ウンカ ヨコバイ | 長楕円 長楕円 長楕円 弾丸 | 380 × 75 255 × 90 350 × 60 200 × 60 |
| 15 | Tymovirus | カブ黄斑モザイクウイルス カクピーモザイクウイルス スカッシュモザイクウイルス. インゲン南部モザイクウイルス | ハムシ ハムシ ハムシ ハムシ | 小球 小球 小球 小球 | 28 28 30 29 |
| 16 | クバコエソウイルス タバコ矮化ウイルス | 菌類 菌類 | 小球 小球 | 25-30 20 | |
| 17 | ジャガイモmop-topウイルス ムギ類萎縮ウイルス イネエゾモザイクウイルス | 菌類 菌類 菌類 | 棒 棒 棒 | 160, 290 170, 250 × 22 275, 550 × 13 | |
| 18 | Nepovirus | アラビスモザイクウイルス タバコリングスポットウイルス タバコblack ringウイルス | 線虫 線虫 線虫 | 小球 小球 小球 | 30 30 30 |
| 19 | Tobravirus | タバコラクトルウイルス エンドウearly browningウイルス | 線虫 線虫 | 棒 棒 | 75, 185 × 20 105, 210 × 20 |
| 20 | トマトspotted wiltウイルス | スリップス | 大球 | 90 |
|
植物ウイルスの感染・増殖過程
宿主細胞への吸着侵入 - 媒介 → アンコーディング → ウイルス核酸の転写翻訳 → ウイルス核酸複製 → ウイルス粒子組立て Ylarr; 隣接細胞へ移行 1. 他動的感染a) 栄養繁殖: 羅病植物の一部が繁殖体となる場合種子・挿木・株分等により次世代へ感染 Ex. 栄養体伝播: ジャガイモウイルス、リンゴ高接病 b) 生物による媒介: 昆虫(植物ウイルスの50%を媒介)・線虫・菌類c) 接触: 全ウイルスが接触により伝播できる Ex. 接木
+ ネナシカズラによる伝染: ネナシカズラ、マメダオシはジャガイモ天狗巣病を媒介 表8.1. 果樹ウイルスの接木検定2. 種子伝染伝染性高い種子中にウイルスがあると検出困難で圃場で発生しやすい。マメ科植物と線虫媒介性植物に種子伝染性のものが多い。種子伝染は被感染植物が変わると行なわれないことがあり、種子伝染がウイルス特有の形質であることを示している ウイルスは全身感染性が一般的だが、種子感染する種のウイルスは少ない → ウイルス-宿主の組み合わせで種子感染の有無、更には感染率が決まる = 宿主変異性が高い 種子伝染 - 花粉伝染[経路1] - 胚嚢伝染[経路2]の関係 → 相関高い 種子伝染には花粉からと胚のからの2経路が考えられる 表 8.5 種子伝染
ウイルス 宿主 種子伝 花粉伝 胚嚢伝
染(%) 染(%) 染(%)
ダイズモザイク ササゲ 0 0 0 ダイズモザイク ダイズ 30-40 2.5 25-40 インゲンモザイク インゲン 40 70 70 アルファルファモザイク アルファルファ 20 0.5-26.5 0-7.7 タバコ輪点 ダイズ 97 90 アズキモザイク アズキ 14.7 5.3 アズキモザイク アズキ 5.6 124 1.4 キュウリモザイク アズキ 0 0 0 ササゲモザイク アズキ 0 0 0 ササゲモザイク ササゲ 3.9 5.6 1.7 表8.2. 種子伝染性ウイルス ウイルス 宿主 種子伝染率(%)
アルファルファモザイク トウガラシ,アルファルファ 0.8-5
アラビスモザイク ダイズ, ペチュニア 2-11
オオムギ斑葉モザイク オオムギ 80-90
アズキモザイク アズキ 9.9
インゲンモザイク インゲン 70
キュウリ緑斑モザイク ユウガオ, キュウリ, スイカ 1.7
ササゲモザイク ササゲ 8
キュウリモザイク キュウリ, ササゲ 4-28
Dodder latent mosaic Cuscuta campestris
レタスモザイク レタス 5-10
イソゲン南部モザイク ササゲ, イソゲン, ダイズ 5
Peanut stunt ダイズ 3.4-4.2
Squash mosaic カボチャ, メロン
ダイズ萎縮 ダイズ, ササゲ 5-100
タバコモザイク トマト
タバコ輪点 ダイズ, ツクバネアサガオ, 54-78
タバコ, メロン
Tomato black ring ダイズ, Nicotina rustica, 23
ナズナ, ササゲ
温州萎縮 インゲン 9
クワ輪紋 ダイズ 11
表. 感染様式。矢印は移動経路。菱形はありえない経路 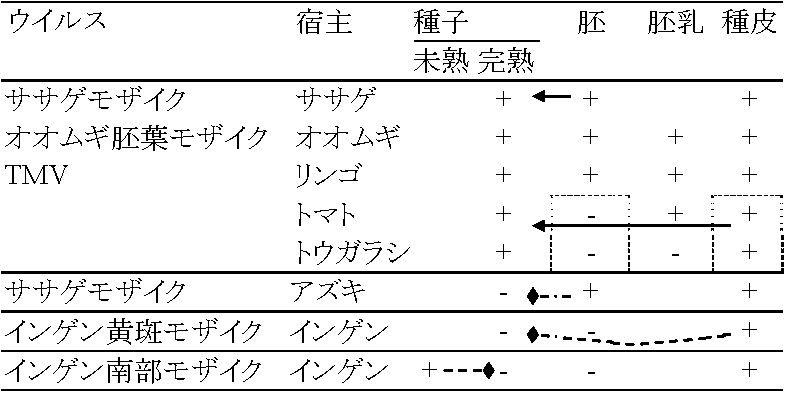 農業上有用情報 Ex. ウィルス: 胚中 = 防除困難 vs 種皮中 = 容易 ⇒ 種皮伝染は、発芽時に子葉が種皮に触れ感染する(有力説)。キュウリ緑斑ウイルスはキュウリ、ユウガオで種子伝染 - アルカリ処理や高熱殺菌等により防除できる 2経路知られるが、種により経路様々で例外多く、その伝播機構は不明の点多+ 花粉伝染自家受粉の場合は防除容易 - 春先防除が重要花粉伝染性のものは(現在知れる所)全て種子伝染する 種子伝染性ウイルスは宿主との関係が強い 3. 土壌a. 線虫 (nematode)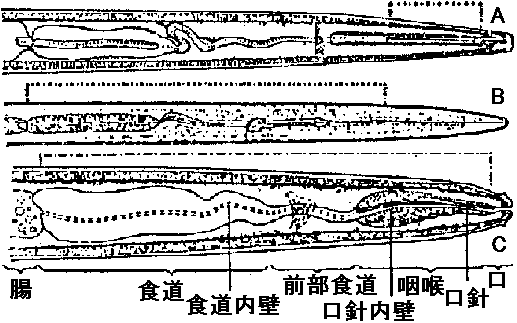 宿主分布(植生)や宿主タイプにより、線虫戦略型が異なるので、ウイルスの生態を知ることが重要(遅れている) 図8.5 線虫体内でのウイルス吸着部分 (Taylor & Robertson)。点線で示した消食管内壁にウイルスが吸着する。A: Longidorus, B: Xiphinema, C: Trichodorus ☛ 表8.6 線虫媒介ウイルス ☛ Nepovirus and tobravirus b. 菌類遊走子によって媒介。遊走子の表面にウイルスが吸着して媒介されているという報告がある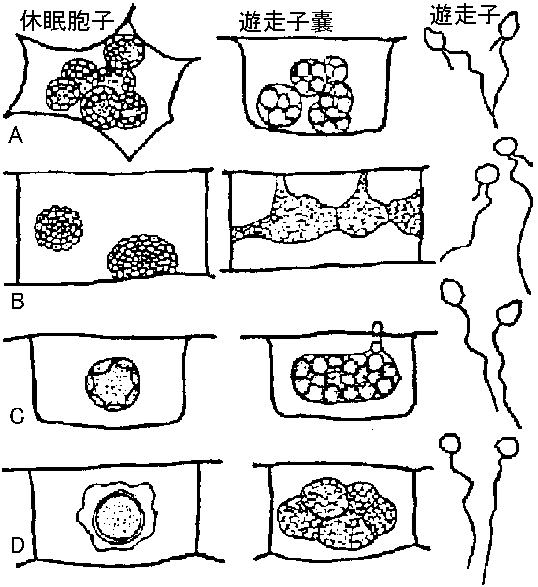 図8.6 ウイルス媒介菌形態(小島)。A: Spongospora subterrana, B: Polymyxa graminis, C: Olpidium brassicae, D: Synchytrium endobioticum 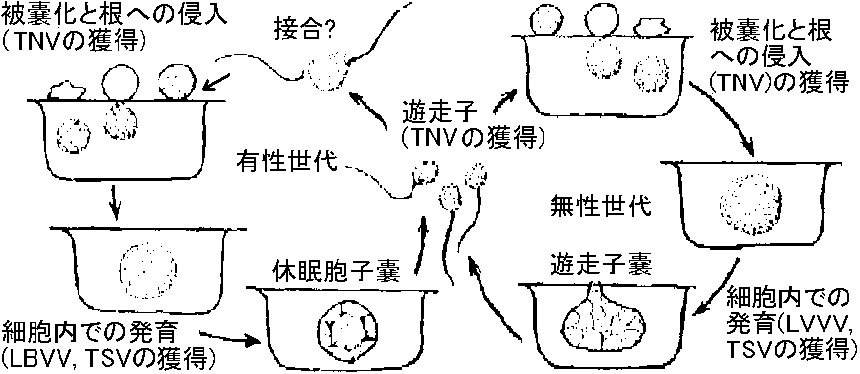 図13. Olpidium brassicaeの生活史(Teakle 1969) |
表8. 9. 菌類によって媒介されるウイルス。*日本でウイルスと媒介菌が共に知られているもの ウイルス: 嫌介菌 (形と大きさ nm), 宿主 タバコ壊疽*: Olpidium brassicae (球, 25), タバコ, イチゴ レタス big-rein: O. brassocae (-, -), レタス タバコ矮化*: O. brassocae (球, 18), タバコ キュウリ necrosis: O. cucurbitacearum (球, 25), キュウリ, ササゲ メロン壊疽斑点*: O. cucurbitacearum (球, 30) ムギ縞萎縮*: Polymyxa graminis (棒, 110-160, 300 × 22), コムギ, オオムギ オオムギ縞萎縮*: P. graminis (紐, 100-275,550 × 1), オオムギ コムギ縞萎縮*: P. graminis (紐, 275, 575 × 13), コムギ イネ壊疽モザイク*: P. graminis (紐, 275, 550 × 13), イネ テンサイ壊疽性巣脈黄化*: P. betae (棒, 65-105, 270, 390 × 20), テンサイ ジャガイモX: Synchytrium endobioticum (紐, 515 × 13), ジャガイモ, トマト ジャガイモ mop top: Spongospora subterranea (棒, 150, 300 × 15), ジャガイモ 4. 汁液機械導入により伝播率が高くなった5. 虫媒Def. 媒介昆虫: 動植物の病気を引き起こす微生物を伝播する昆虫同翅亜目を媒介とするウイルスは非常に多い 非永続的 (口針型): potyrivrus, cueumovirus 半永続的 (通過型) 永続的
循環型: luteovirus, 口針から取り入れたウイルスが体内を一回りする間が潜伏期 – 口針からとったウイルスは唾腺から出る 媒介動物の分類上の位置 (媒介虫数, ウイルス数): 適用 無脊椎動物 Invertebrate (旧口動物 Protostomia) (506, 320) 線形動物門 Nemathelminthes 線虫綱 Nematodes
ネセハリチュウ目 Drylaimida (20, 14) 節足動物門Arthropoda 蛛形綱Acarinida ダニ目 Acarina: mites
フシダニ上科 Eriophyodea (8, 10) 昆虫綱Insecta (Hexapoda)
ハサミムシ目 Dermaptera (革翅目) (1, 1) 頸吻群 Auchenorrhyncha (162, 76): (MLO)を含む
ウンカ上科 Fulgoroidea: planthopper 腹吻群Sternorrhyncha
キジラミ上科 Chermoidea (1, 1): (MLO), psylloidea
鞘翅目 Coleoptera (30, 20): beetle (ハムシ, 甲虫) アブラムシ (aphid)ハムシ (leaf beetle)表8. 22 ハムシ(甲虫)媒介ウイルス (Walters)ウイルス: 媒介甲虫 虫体内保有期間(日)/粒子成分/RNA含量(%) Cowpea mosaic virus group
Squash mosaic: Acalymma trivittata 17/ 3/35
カブ黄斑モザイク Ph. atra -/ -/37
インゲン南部モザイク Cerotoma trifurcata 5/ 1/23 ダニ (tick)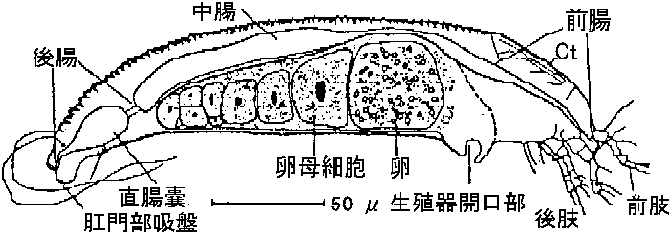 図8.15 Aceria tulipae (Slykhius). コムギstreakモザイクウイルスは後腸と中腸の後方に見出される。Ct: Cephalothorax頭胸部。直腸嚢は後腸部にある → 表8.23 ダニ媒介性ウイルス(Slykhius) コナジラミ (whitefly)表8.24 コナジラミ媒介ウイルス (Sambrook et al. 1989)
問題1. ゲノムマスキング (genome masking)→ 系統の異なるウイルスが宿主に入ると後に起こる系統の異なるウイルスを入らないようにする機構がある。しかし、それがないウイルスがいる = 同時複製 (simultaneous replication) 2. ヘルパー成分 (helper component) 混合感染等から、媒介昆虫とウイルスの特異性は、外膜タンパク質の特異性に基づくものと考えられる。外膜により認識し、ゲノム型の病気起こす → genome masking Helper component: 混合感染により本来かからないウイルスが植物に罹る現象がみられる
Ex. → 依存的 dependent ジャガイモX, ジャガイモY (アブラムシ感染) → helper virus YがFと一緒にいるとFはアブラムシで媒介 – helper本体未詳 (タンパク質性が有力視) 依存ウィルス dependent virus: 報告例は1種
========== + ██ → ==========██ 交叉防衛 cross protectionEx.TMV-L: トマトに感染, TMV-LII: トマトに弱く感染 MV-LII-A: トマトに潜在 potential 予めTMV-LII-Aを感染させておくとL, LII病状でず病理上利用されるが、potential virusがmutationを起こさない保障はなく、ウイルスが土壌中に広がり農業汚染も考えられる。このウイルスが例えばトマトの新しい系統株を使用したときに弱毒であるとは限らない |
| 宿主 | ウイルス | 媒介者 | 分布 |
| イネ | 萎縮 Gall dwarf 矮化 Tungso 黄葉 黒条萎縮 縞葉枯 Ragged stunt Grassy stunt Yellow mottle 壊疽モザイク 黄萎病 ナハブランカ | ツマグロヨコバイ タイワンツマグロヨコバイ タイワンツマグロヨコバイ タイワンツマグロヨコバイ クロスジツマグロヨコバイ ヒメトビウンカ ヒメトビウンカ トビイロウンカ トビイロウンカ ハムシ Pohymyxa gsaminis ツマグロヨコバイ ウンカ | 本州、韓国 タイ 九州 フィリピン、タイ、インドネシア 台湾、沖縄 北海道、本州、韓国 北海道、本州、韓国 九州、フィリピン,インドネシア 九州、フィリピン,インドネシア アフリカ(ケニア) 本州 本州、台湾、南アジア 中南米 |
| トウモロコシ | キュウリモザイク サトウキビモザイク イネ縞葉枯 イネ黒スジ萎縮 | 汁液、アブラムシ 汁液、アブラムシ ヒメトビウンカ ヒメトビウンカ | 本州 本州 本州 本州 |
| ムギ類 オオムギ、コムギ オオムギ、コムギ、エンバク、ライムギ オオムギ、コムギ、エンバク、ライムギ オオムギ、コムギ、エンバク オオムギ、コムギ オオムギ、コムギ、エンバク オオムギ、コムギ、ライムギ、エンバク | オオムギ斑葉モザイク ムギ北地モザイク ムギ縞葉枯 ムギスジ萎縮 ムギ萎縮 オオムギ縞萎縮 コムギ黄枯 エンバクレッドリーフ病 オオムギ黄化萎縮 | 汁液、種子 ヒメトビウンカ ヒメトビウンカ ヒメトビウンカ P. graminis P. graminis アブラムシ アブラムシ アブラムシ | 北海道、本州 北海道、本州 本州 本州 本州 本州 本州 本州 本州 |
| ユリ | アラビスモザイク ブロードビーンウイルス カンキツタツターリーフ キュウリモザイク リリーシンプトムレス タバキ茎壊疽 タバコ輪点 チューリップブリーキング | 線虫、種子 汁液、アブラムシ 汁液、アブラムシ 汁液、アブラムシ 汁液、アブラムシ 汁液、線虫 汁液、線虫 汁液、アブラムシ | |
| イチゴ | モツトル クリンクル マイルドイエローエッジ ベインバンディング タバコネクロシス タバコモザイク | イチゴケアブラムシ イチゴケアブラムシ(非永続的) イチゴケアブラムシ(永続的) イチゴケアブラムシ(非永続的) Olpidium brassicae 汁液 |
長円形 球25 nm 球50 nm 球25 nm 棒18 × 300 nm |
| 果樹 | ウイルス | 検定植物 | 病徴 |
| リンゴ | 高接病
マルバ系-CLSV stem pitting (SPV) |
マルバカイドウミツ ミツバカイドウ R12740-7A Virginia Crab K16 |
黄化斑点、樹皮・木賀部の壊死、stem pitting 黄化斑点、樹皮の壊死、stem pitting stem pitting |
| カソキツ | トリステザstem pitting seedling yellows ニクソコーティスexocortis | Mexican lime Eureka lemon, grape fruit, sour orange Etrog citron (USDCS 60-13, Arizona g-61) |
葉脈透明、stem pitting、脈のコルク化 葉化、生育障害 巻葉、葉脈や九基のコルク化 |
| モモ | Necrotic ring spot | シロフラゲン(白普賢、ヤエザクラの1種) | 活着しない、芽接部にヤニ分泌、樹皮や木質部の壊死 |
| ブドウ | Fan leaf Enation | St. George、ピノーチャードネー、ミッション LN 33、ミッション、Baco 22A、ピノーノア | 線状斑、扇状葉 早期紅葉、矮生化 |
| ウイルス | 緑虫名 | 大きさ | 宿主 |
|---|---|---|---|
| Tobravirus group | |||
| タバコ茎えそ(欧州株)* | Paratrichodorus anemones, P. nanus, P. pachydermus, P. teres, P. minor, Trichodorus cylindricus, T. primitirus, T. similis, T. viruliferus | 180 × 25 | ジャガイモ, 球根類, タバコ |
| タバコ茎えそ(アフリカ株) | P. allius, P. minor (= P. christiei), P. porosus | 80 × 25 | レタス, ジヤガイモ, トウガラシ, タバコ |
| エンドウearly | エンドウ, アルファルファ | ||
| browning (オランダ株) | P. pachydermus, P. teres | 210 × 25 | |
| browning (イギリス株) | P. anemones, T. primitivus, T. viruliferus | 105 × 25 | |
| Nepovirus group | |||
| アラビスモザイク* | Xiphinema diversicaudatum, X. coxi, X. bakeri | 30 | キュウリ, ブドウ, ラズベリー, チェリー, ルパープ, ホップ, スイセン |
| Cherry leaf roll | X. diversicaudatum, X. coxi, X. vuittenezi | 30 | チェリー, ブラックベリー, エルム, ルバーブ |
| ブドウ fan leaf | X. index, X. italiae | 30 | ブドウ |
| クワ輪紋* | Longidorus martini, L. elongatus, L. macrosoma, X. diversicaudatum | 22 | クワ |
| Raspberry ring spot | 30 | ブラックベリー, ラズペリー, イチゴ | |
| イチゴlatent ring spot | X. diversicaudatum, X. coxi | 30 | Blackcurrant, チェリー, セルリー, モモ, プラム, lackcurra ラズベリー, バラ, イチゴ |
| タバコ輪点* | ナミオオガタハリセンチュウ, X. americanum, X. coxi | 30 | インゲン, ブルーベリー, グラジオラス, ブドウ, タバコ |
| トマト黒色輪点* | ナガバセンチュウ L. attenuatus, L. elongatus | 30 | セルリー, レタス, モモ, ジャガイモ, ラズベリー, イチゴ, テンサイ, トマト |
| トマト輪点* | ナミオオガタハリセンチュウ | 30 | ブラックベリー, チェリー, ブドウ, モモ, ラズベリー, タバコ |
| その他 | |||
| Brome mosaic | X. diversicaudatum, L. macrosoma | 牧草, ムギ類 | |
| カーネーションring spot | X. diversicaudatum | カーネーション | |
| Prunus necrotic ring spot | L. macrosoma | プラム |
| ウイルス | 媒介ダニ | 伝染率 | 虫体内保有期間 | 植物体内潜伏期 | 汁液伝染 | |
| 禾木 | コムギstreakモザイク | Aceria tulipae | 34 | 9 | 5-10 | + |
| コムギspotモザイク | Ac. tulipae | 65 | 13 | 3-10 | - | |
| Ryegrassモザイク | Abacarus hystrix | 30 | 1!2 | 10-14 | + | |
| Agropyronモザイク | Ab. hystrix | 1 < | 5-10 | + | ||
| 木本 | Current reversion | Cecidophyopsis ribis | 1 < | > 365 | ||
| Figモザイク | A. ficus | 70 | 10-90 | |||
| モモモザイク | Eriophyes insidiosus | 2.5 | 2 | 14-100 | ||
| Pizeon pea sterility | E. cajan = Aceria cajani | 10 < | 21-35 | |||
| バラ rosette | Phyllocoptes fructiphilus | 10 < | 3-146 |
|
温度: 病徴に大きく関与 → 防疫検査では理化学的検査必要 湿度 光 ウイルス源: 1: seed, shoot, tuber. 2: 雑草、樹木 Ex. ダイズ矮化ウイルス – ジャガイモヒゲナガアブラムシ ダイズ – 縮葉型: 赤クローバ、黄化型: 白クローバ(= 汚染源) – インゲン黄化
Ex. イネ縞葉枯病 = RDV – ツマグロヨコバイ、RSV – ヒメトビウンカによる増殖型感染
雑草: 1. 特に多年生のものでは発病させない。2. 媒介根昆虫の巣駆除 |
表12 ウイルス抵抗性、免疫性品種 (ウイルス 品種) Xウイルス 免疫性品種: Saco, Tawa, USDA 41956, 金時薯 抵抗性品種: 神谷薯, ペポー, メークイン, ウンゼン, タチバナ, チトセ, ホッカイアカ Yウイルス 抵抗性品種: USDA 41956, Russet-Burbank, Utrica, Fortunia, Nordak, 金時薯, ケネベック, ウンゼン,チヂワ, ユキジロ, エニワ Sウイルス 免疫性品種: Saco 抵抗性品魎: ホイラー, メークイン, ウンゼン, 金時薯, 三円薯, 農林2号 Aウイルス 免疫性品種: Merrimack 抵抗性品魎: Tawa 葉巻ウイルス 抵抗性品種: Tampa, Bliss, Triumph, Katahdin, Capella, Fortunia, シマバラ, ビホロ, ユキジロ, 金時薯 |
| 病徴 | ウイルス量 | ||||
| ウイルス-宿主 | 温度範囲 | 低温 < 高温 | 低温 > 高温 | 低温大 | 高温大 |
| ジャガイモyellow dwarf-ジャガイモ | 15-25 | O | |||
| ジャガイモX-ジャガイモ | 15-25 | O | O | ||
| ジャガイモX -N. glutinosa | O | ||||
| ジャガイモX -タバコ | 16-28 | O | (20-24) | ||
| ジャガイモX -トマト | 20-28 | O | O | ||
| ジャガイモX -センニチコウ | O | ||||
| ジャガイモX -アカザ | O | ||||
| ジャガイモX -Datura | O | ||||
| タバコモザイク-アンバレマ | 16-28 | O | O | ||
| タバコモザイク-タバコ | 20-37 | O | (24) | ||
| タバコモザイク-タバコ | 16-28 | O | O | ||
| トマト黄化えそ-トマト | 20-36 | O | |||
| トマト黄化えそ-トマト | 36 | O | O | ||
| キャベツblack ring-キャベツ | O | O | |||
| ハナヤサイモザイク-キャベツ | O | ||||
| Horseradishモザイク-キャベツ | 16-28 | O | O | ||
| ジャガイモS-N. debneyi | 20-30 | O | O | ||
| アルファルファモザイク-ソラマメ | 17,24 | O | O | ||
| ジャガイモmop top-タバコXanthi nc |
|
1) CaMV: dsDNA virus - 導入成功 2) 根頭癌腫病(クラウンゴール, crown gall) Agrobacterium tumefasseiens: 多くのplasmidを有する。その内の1つにTi plasmidがあり、それが病気を発現させる。そのplasmidが植物体(host)のDNA strand中に移ることが確認された → これに狙った遺伝子を移してhostに形質を移す ある程度成功しているが問題は多い。まず、plasmid fragmentがhost DNA strandに移るのはガン化した所のみであり、host全体で形質発現するわけではない。また、狙ったfragmentをplasmidのどこに入れればよいかが、ガン化せず、そのfragmentの形質がでるかが問題である |
3) RNAそのものの導入 Ex. PSTV (RNA) → cDNA: cDNAで発現する |
|
1967 Diener & Raymer: 病原 = 低分子RNA
タンパク反応無。遠心沈殿せず。RNase入れると反応消失 = 核酸のみ = タンパク質持たない
真核生物イントロン部塩基配列に似る300 base ssRNA ↔ 動物: 原因不明病からもウイロイド検出例なし 増殖系(ウイロイド)真核生物splicing過程: snRNA (sn: small nuclear)必要仮説1: snRNA sequenceとviroid sequenceのhomology高い → viroidは増殖系を真核生物内に持つ 仮説2: virus中にviroid sequenceに似たものが見つかりviroidと命名→ virus → virusoid → viroid 遺伝子配列は容易に決定された - 遺伝子バンク gene bankEx. PSTV, CEV, CCCV, ASBV, VTMoV, SNMV 分類 (ウイロイド種)ウイロイド(病): ウイスル病初報告-低分子量RNA病原初報告低分子量RNA: 分子量(×106 Dt) 沈降係数(S20, w) (塩基組成) ヌクレオチド数 伝染方法: 人為多接木・挿木、受粉昆虫(Matsuura et al. 2010)、種子 地理的分布Fam Avsunviroidae Avsunviroid Pelamoviroid キク退緑斑紋病 (Chrysanthemum chlorotic mottle viroid, ChCMV)
Dimock et al. (1971) - Romaine & Horst (1975) |
Fam Pospiviroidae Pospiviroid カンキツ・エクソコーチス病 (Citrus exocortis viroid), CEV
Fwcett & Klotz (1948) - Semancik & Weathers (1968)
Dimock (1947) - Diener & Lawson (1973) = Hop stunt viroid, peach dapple viroid, plum dapple viroid
N/A - Van Dorst & Peters (1974)
Ocfemia (1937) - Randles (1975), Randles et al. (1977) ホップ矮化病 (Hop stunt viroid)
山本ら (1971) - 佐々木・四方 (1977) Apscaviroid Coleviroid ジャガイモやせ芋 (Potato spindle tuber viroid), PSTV
Martin (1922) - Diener & Raymer (1967) |