(2024年3月12日更新) [ 日本語 | English ]
HOME > 講義・実習・演習一覧 / 研究概要 > 小辞典 > 酵素
化学変化 chemical change≡ 物質の種類変化 → 化学反応, s.l.: 化学作用 chemical action により起こる化学反応式 (化学方程式) → 化学的特性(化学的性質) Ex. HCl + NaOH → NaCl + H2O イオン反応式: 反応前後で変化しないイオンを省略(化学反応式の1種)Ex. H+ + OH- → H2O 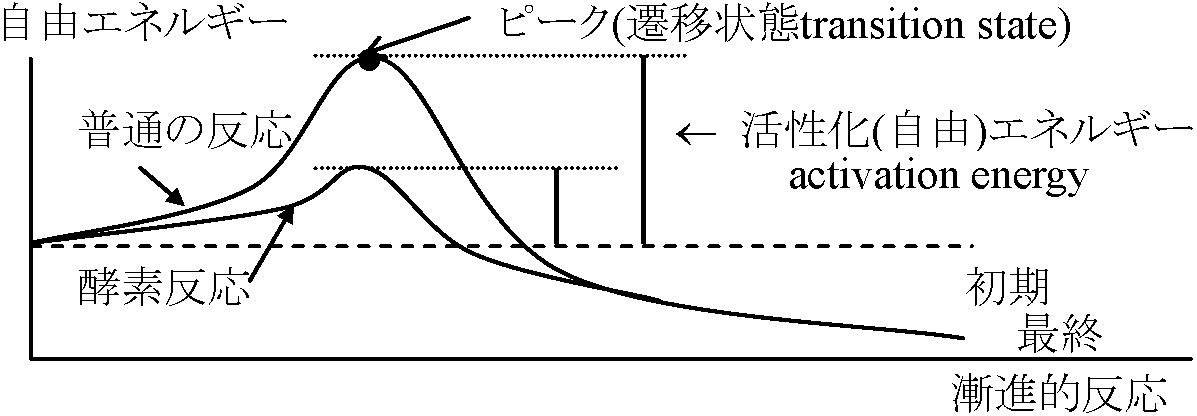 Def. 活性化エネルギー activation energy: 反応の出発物質基底状態から遷移状態に励起する必要エネルギー (kJ/mol or kcal/mol)
[ 化学反応は必ず活性化状態を通る ] = 2NH3 + 11 × 2 kcal (反応熱) + 54 kcal (放出 = 22 + 54) |
化学平衡 chemical equilibrium化学的に: 安定(不活性) ↔ 不安定(活性)Def. 不可逆反応: X → Y Def. 可逆反応: X ↔ Y Def. 平衡状態 (可逆反応のみ)
_ v1 光化学反応 photochemical reaction光の吸収によって起こる化学反応光化学平衡 photochemical equilibrium: 光化学反応で到達する化学平衡 化学量論 (stoichiometry)化学反応における量的関係を説明する理論
質量保存の法則 |
|
化学反応を促進するが反応前後で変化しない物質
触媒作用は化学平衡自体を変えることはない ≡ 活性化エネルギー低下させる物質 [触媒は近道だ]1823 Döbereiner, Johann Wolfgang
白金片に水素吹き付けると燃える - 白金は減らない
N2 + 3H2 → 2NH3 ル・シャトリエの原理: 発熱反応(400-500°C) - 圧力かける 1943 北海道大学触媒研究所設立 |
1950s 反応平衡 WII後: 化学工業発達 → 合成ゴム(米国), 衣料品, ナイロン, poly-propylene
CO2 + H2 → HC(ハイドロカーボン) 1990s' 計算機科学 → 密度汎関数(DFT)法普及 2010 Heck, 根岸, 鈴木(章)
ノーベル賞: 有機合成におけるパラジウム触媒クロスカップリング 反応 reaction (実際起るかどうか)Carbon → Diamond: (1-3 × 103 K) + (3 × 104-105 atm) + Ge, Ni (核・触媒)反応条件 Ex. O2 + 2H2 → 2H2O: Pt触媒があれば常温で反応 触媒反応 catalysis or catalytic reaction可逆反応平衡点に影響与えず平衡点に達する時間短縮可逆反応両方向へ促進する作用 |
酵素 (enzyme)生体で起こる化学反応に対し触媒として機能する分子
|
|
酵素化学発展は、消化 digestion・発酵 fermentation 研究に負う部分多 1814 Kirchhoff: デンプンに麦芽抽出液を入れるとマルトースとなることを発見 1830 Kuehne: En (in) + zyme (yeast)という用語を提案 1833 Payen, Persoz: 麦芽で水抽出を行い抽出液にアルコールを加える
沈殿 → 麦芽中にアルコール不溶性物質存在
動物は全て"アルブミン様物質"もちC/H/O/Nが一様であると指摘 高峰譲吉 1854-1922, 化学、越中国高岡(富山県高岡市)生
1879 工部大学校(東大工学部)首席卒業(応用化学科第1期生)
高峰式元麹改良法 - 麦芽使用に比べ効率的・低コスト
1894 タカジアスターゼ発見 - 世界的販売 仮説: 麹液には人の消化を助ける機能もある
麹水浸出 + アルコール → 沈殿 → 粉末化 → 消化酵素 三共商店(第一三共)が販売
1900 アドレナリン結晶化成功 - 世界初のホルモン抽出 1897 Buchner兄弟(兄: 科学者、弟: 医学者?):
イーストを擦り潰した抽出物でも(イーストがなくても)発酵することを発見(後談: 当時免疫療法研究盛ん → 彼らも免疫作成を狙い研究 → 本研究により発酵・消化をつかさどる物質(酵素)を生体から抽出し物質構造を解析する研究発展) |
1907 フィッシャー: タンパク質がアミノ酸のペプチド結合であることを提唱
「酵素作用とは錠前のと鍵との関係に例えられる」(現在この比喩は適切でないとされる) 1920代まで: タンパク質はペプチドの様々な集合体とみなされ本当の巨大物質とは見なされていなかった1922 Freming: 細菌細胞壁の多糖類を分解しライソゾームlysozome発見 分子量14600、129のアミノ酸からなる 1926 Sumner JB: ナタマメからウレアーゼ抽出結晶化(世界初)
酵素本体はタンパク質 = Urease: CO(NH2)2 →enzyme 2NH3 + CO2
1930: ペプシン結晶化, 1931: トリプシン結晶化 1953 Sanger: インシュリン一次構造決定 1960 Kendrew, Perutz: Mb三次元構造決定 1965 Phillips DC: X線解析によりリゾチーム lysozyme 立体構造決定 = 最初に立体構造が明らかになった酵素 1965 高崎義幸 他: グルコースイソメラーゼを用い異性化糖製造法を開発1968 Smith HO, et al.: DNA制限酵素発見 1968 ジョー・マッコード、アーウィン・フリドビッチ (USA): スーパーオキシドジスムターゼ(superoxide dismutase, SOD, 活性酸素分解酵素)発見 1969 Merrifield RB (USA):ペプチド固相合成法 → 化学的にリポヌクレアーゼ合成成功 1986 Cech T (USA): リボザイム(ribozyme, 触媒作用を有するRNA) 発見触媒作用はタンパク質に依らない ☛ RNAワールド 1986 von Richard AL, Schult P, et al.抗体酵素(abzyme = antibody/enzyme)発見 |
0. 極微量で有効回転回数(1 molの酵素によって1分間に生成物に変えられていく物質のモル数) = 100-10001. 反応触媒 catalyst2. 温度効果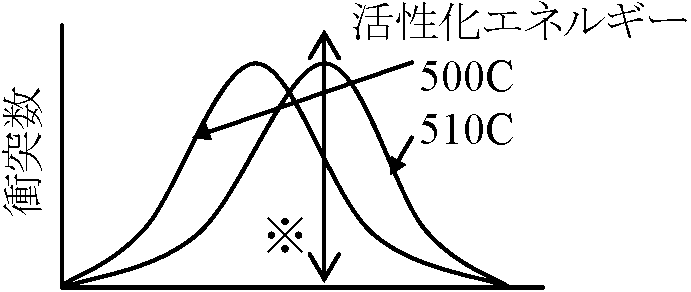 ※衝突数の増加分 ※衝突数の増加分
2HI → H2 + I2 アーレニウスArrheniusの化学反応式活性化エネルギー(E)を考慮し、絶対温度との関係を経験的に導くdlnK/dT = E/RT2 K: 反応速度定数, T: 絶対温度, R: 気体定数, E: 活性化エネルギー lnK = -E/R·(1/T) + constantln(K1/K2) = E(T2 – T1)/(2.303 × 1.987 × T1·T2)___T1 → K1 ________= (0.219·E·(T2 - T1))/(T1·T2)_________T2 → K2 E = log(K1/K2)·(T1·T2·4.6)/(T2 - T1) __= ΔH + RTで表わせる(H ≡ エンタルピー) em>Eは活性エンタルピーと呼ぶことがある Q10: (一般に) T (温度) ∝ V (反応速度) ⇒ 温度 10°C増加 → 反応速度 2倍
Q10 = [V1(T1 + 102)]/(v1T1)
アレニウスプロット Arrhenius plot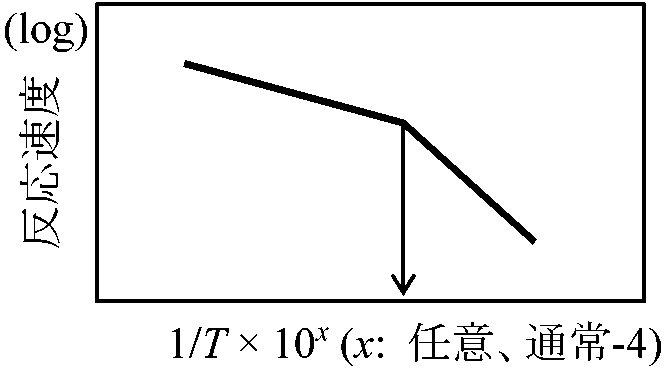 酵素活性がある温度を境に変化する(Ex. 低温障害) → 相転移 phase transition 酵素活性がある温度を境に変化する(Ex. 低温障害) → 相転移 phase transition
|
3. pH効果 (v-pH関係)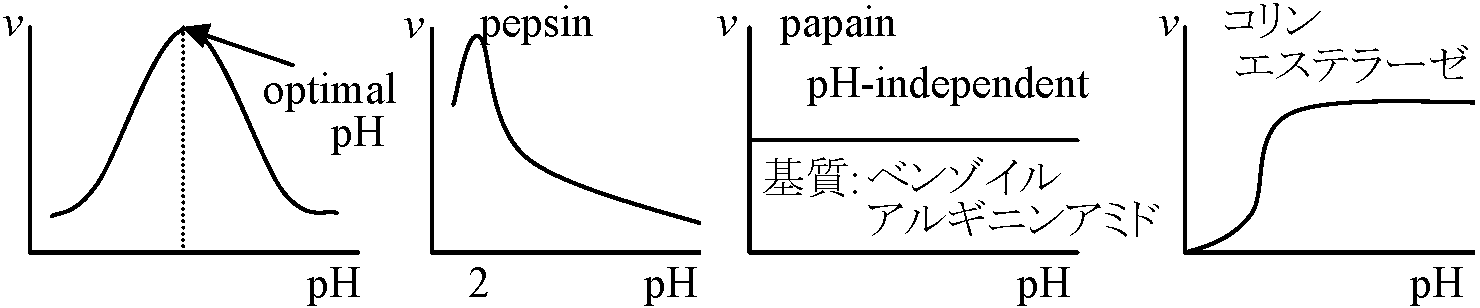 一般に酵素の最適pHはpH 5-8。アミノ酸は両極性イオンであり酵素は側鎖に合わせた荷電状態にありその荷電に合わせて最適pHが決定される リボヌクレアーゼribonuclease: 124アミノ酸。34極性部位を持ちpHの影響受け易い。0チャージではproteinは不溶(不活性)となりやすい  ☛ 等電点 ☛ 等電点
4. 特異性 specificity基質特異性特異性の程度に応じて分けた場合(細区分する人もいる)絶対特異性: 非常に高い特異性を示す
Ex. ウレアーゼ Urease 尿素
反応しない 群性特異性: eg., α-glycosidase, Trypsin, Phosphatase: これらの各々はα-glycosideのタンパク質結合部がArg-Lysであり、リン酸ならすべて反応し、場合によっては加水分解を行う 立体特異性: α-glycosidaseとβ-glycosidaseは異なる酵素 光学特異性: D-amino acid oxidase, L-amino acid oxydaseは異なる酵素 作用(反応)特異性酵素により同一基質を用いても異なる反応を示す。反応部位構造がある限られた反応しか触媒しない。結合した物質が反応を仲立ちできるかできないかアミノ酸 → 酸化還元
___→ アミノ基転移 グルタミン合成酵素 (glutamine synthetase, GS)= グルタミン酸-アンモニアリガーゼリガーゼの一種: EC 6.3.1.2 グルタミン酸とアンモニアからATPのエネルギーを利用しグルタミンを合成Glu + NH3 + ATP → Glu + ADP + Pi 無機窒素固定とアミノ酸生合成に重要
タンパク質一次構造 土壌細菌(Frankia, Rhizobium, Streptomyces)は両方持つ種存在
III型: 窒素欠乏状態で増加 |
[ ビタミン ]
|
酵素補因子 (enzyme cofactor) =
補酵素 (coenzyme) + 補欠分子族 (prosthetic group) 補酵素 (coenzyme)= 助酵素、コエンザイム= 低分子量の有機化合物: 酵素のタンパク質部分と強い結合を行わず可逆的に解離して遊離型になる ↔ 補欠分子族: 不可逆的な解離を行う ホロ酵素 Holoenzyme= アポ酵素 apoenzyme + 補酵素 coenzyme複合タンパク質からなる酵素のうち特に透析その他の方法によって低分子成分が可逆的に分離できる → タンパク質部分をアポ酵素、低分子部分を補酵素 coenzyme と呼ぶ。両者の結合した触媒機能を有するものをホロ酵素という。一般に容易にタンパク質と解離するが、補酵素が共有結合によってタンパク質と強く結びついている時には補酵素の部分を補欠分子団(族) prosthetic groupという heme (Feを含む) + protein = cytochromes フラビン (flavin)脱水素あるいは酸化酵素フラビン + ビタミンB1 = リボフラビン (vitamin B2 or G) → 動物合成できない リボフラビンが補酵素としてFMN, FADに結合すると脱水素(= 酸化)酵素となる NAD·NADP (pyridine nucleotides) (NAD·NADP)NAD+, NADP+ともに脱水素酵素だが種・代謝経路等により要求性様々1933 Euler: NAD+発見 (coenzyme I, DPNと命名) ニコチンアミドアデニンジヌクレオチド 1934 Warburg: NADP+)発見 (coenzyme II, TPNと命名)
ニコチンアミドアデニンジヌクレオチドリン酸
リポイックアシッド (lipoic acid, or thioctic acid)α-ketoacids (pyruvate α-ketoglatarate)に関与する補酵素→ 酸化還元反応(限られたもの) -S-S- → -SH, -SH: タンパク質のリジン残基と強く結合する チアミン (サイアミン/アノイリン, thiamin(e))脱炭酸反応酵素decarbonylation補酵素結合したものはthiamine pyrophosphateとして機能 Pyruvate decarboxylase TPP (DPT)
CH3COCOOH → [TPP] → CH3CHO + CO2
= チアミン二リン酸 thiamine diphosphate, ThDP
|
2[α-hydroxyethyl] thiamine pyrophosphate
ピリドキシン pyridoxine結合した酵素は pyridoxal phosphate→ アミノ基転移反応(transamination reaction) Pyridoxial-P-α·AA → Pyridoxiamine-P + α-keto acid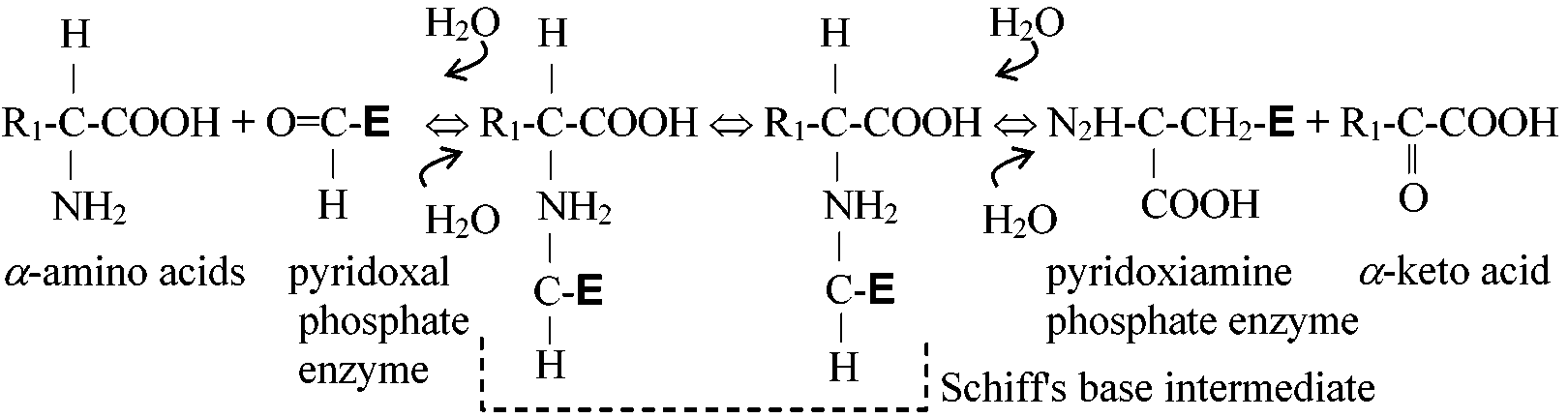 COOH-HCNH2-(CH2)2-COOH (gulutamate) + CH3-CO-COOH (pyruvate) → COOH-CO-(CH2)2-COOH (α-keto glutamate) + CH3-NCNH2-COOH (alanine) ビオチン biotin, vitamin B7全生物種必須栄養素 ⇔ 生合成: 一部の微生物やカビ、植物に限られる機能: カルボキシル基転移酵素carboxylaseの補酵素 Def. ビオチン酵素 biotin enzyme: ビオチンを補酵素として持つ酵素 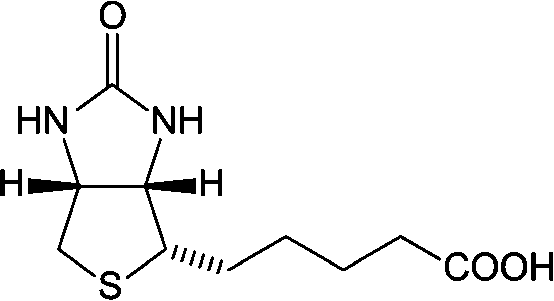
Ex. ピルビン酸カルボキシラーゼ、アセチルCoAカルボキシラーゼ、プロピオニルCoAカルボキシラーゼ、3-メチルクロトニルCoAカルボキシラーゼ CO2転移反応リジン側側鎖に共有結合 → Avidine(生卵中存在)はビオチン阻害剤 葉酸 folic acid, FH4C1-complex(vitamin B複合体)形成C1化合物 (-CH2OH, -CHO, -CH3)の転移 プリン・ピリミジンの生合成 生体内ではtetrahydrofolic acid (FH4)の形で機能
基本骨格  (a) (a)
 (b) (b)
 (c) (c)
5-メチルテトラヒドロ葉酸 N5-Methyl FH4 CH2OH-NH2(-CH)-COOH___H-NH2(-CH)-COOH 2. N5, N10-Methylen FH4 + NADP + H+ ⇔ N5-Methyl FH4 + NAD+3. N5-Methyl FH4 + Homocystine [SH-CH2-CH2-(HC)NH2-COOH] ⇔ Methionine [CH3-S-(CH2)2-HCNH2-COOH] + FH4 補酵素A (coenzyme A)C21H36P3N7O16S (mw 767.5 g/mol)脂肪酸代謝反応 = アシル基の運搬者
CoA-SH |
|
Def. 酵素に永久的に結合する非タンパク質(非アミノ酸)要素 (≠ 補酵素) Ex. 有機物(ビタミン、糖、脂質等)、無機物(金属イオン) 有機物 organic substancesビタミン誘導体: チアミン(ビタミンB1)、チアミンピロリン酸、ピリドキサールリン酸、ビオチン |
金属 metals低分子であり熱に安定Zn2+, Mg2+, Mn2+, Fe2+ or Fe3+, Cu2+ or Cu+, Mo, K+, Na+ 傾向
|
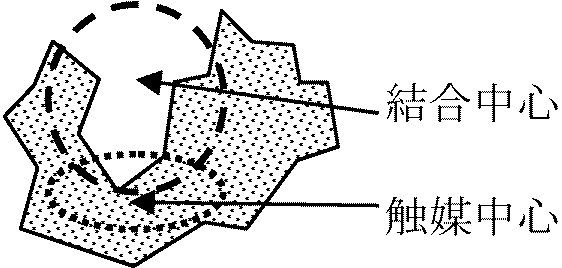 結合中心(結合部位): 結合にあずかる部分。回りのアミノ酸残基の立体構造による
結合中心(結合部位): 結合にあずかる部分。回りのアミノ酸残基の立体構造による触媒中心(作用部位): 触媒作用にあずかる部分 単純タンパク質でアミノ酸残基、複合タンパク質で補欠分子族の存在部分 酵素基質複合体
|
酵素の活性化プロティナーゼ: 分泌時は不活性で後活性化する。自己タンパク質と養分タンパク質を区別するのに都合がよい。胃壁、腸壁は分泌される多糖類の粘液により酸、ペプシンの作用から保護されている。胃潰瘍は保護粘液の減った胃壁細胞が自己消化するために起こるトリプシン: トリプシノーゲンの始めの6アミノ酸がエンテロキナーゼ、トリプシンにより取り除かれ、その立体構造が変わり活性中心が形成される。塩基性アミノ酸(アルギニン、リジン等)のカルボキシル基側を切る ペプシン: ペプシノーゲンの大きなペプチド1個と小さなペプチド幾つかが切断され活性化 インシュリン: プロインシュリンは81-84個のアミノ酸からなる1本鎖。あるペプチド部分が失われて2本鎖になる Q. 大腸菌カルバモイルリン酸シンテターゼは、小サブユニット(分子量 40,000)、大サブユニット(分子量 130,000)各一個からなる。分離した小サブユニットはグルタミナーゼ活性を持ち、大サブユニットはアンモニアからカルバモイルイリン酸を合成(この時グルタミン酸は無効)。小サブユニットはHCO3-存在下でATPアーゼ活性も持つ。完全酵素の行う最もありそうな反応機構を書け |
速度論反応(生成)物濃度時間変化(速度) → 因子効果から反応機構特定(手法限界)化学反応速度・軌跡を、理論実験両面から力学的に扱う 物質濃度から反応速度微分方程式立て、濃度時間変化求め反応進行把握 律速段階(律速過程) rate-determing process: 反応速度の一番遅い反応が全反応を支配する 反応reaction非可逆的反応 + 可逆的反応 + 複合反応等 → 反応の速さreaction speed複合反応[近似的解法が主
┌→ 反応機構決定する
│ 反応式導く
│ 速度式 実験
│ v = f(T, S) 照合(速度 速度の濃度
│ │合否判定 パラメータ) 依存性
No ←───┘ Yes
実験結果の速度式に基づく解釈
(速度パラメータの物理的意味)
外的因子の影響を調べる
(温度、圧力、溶媒、pH等)
No 素過程の解釈 Yes
図. 速度論の基本的手法。T: 温度変数、S: 速度定数
化学反応速度論 chemical kinetics気体分子運動論等、ミクロな立場から反応機構を考えるEx. 衝突理論から反応速度定数求める。反応に関わる分子のSchrödinger方程式を近似的に解き化学反応ポテンシャル曲面から反応の軌跡を捉える。遷移状態理論から反応速度定数を求める Def. 反応速度: 単位時間あたりの反応物(A)のモル濃度減少量速度単位活性 activity ↔ 比活性 specific activity分子活性(回転率) (molecular activity or turnover number)
1961年: 1U = 1 μmol/min, U/mg·protein, U/μmol·protein·min-1 6 × 108U, katal/kg·protein, katal/mol·protein·s-1 可逆反応: 反応によっては生成系から反応系への変化(逆反応)も生じるEx. H2 + I2 → 2HI ⇔ 2HI → H2 + I2 ⇒ H2 + I2 ↔ 2HI Ex. 2NO2 ↔ 2NO + O2Ex. CH3COOH + C2H5OH ↔ CH3COOC2H5 + H2O Ex. N2 + 3H2 ↔ 2NH3 ____k+1___k+2 E + S ⇄ ES ⇄ E + P ____k-1___ k-2 0次反応化学速度: 反応系の成分濃度や分圧に無関係-(d[A]/dt) = k0[A]0 = k0
k0: 速度定数 ⇒ 反応物濃度に依存しない |
Case. 平衡状態: αA + βB + … ↔ γD + δE + … 各物質濃度(mol/l): [A], [B], [C], [D], … ⇒ Kc = ([A]α·[B]β …)/([C]γ·[D]δ …) Def. 平衡定数 ≡ Kc Law. 質量作用の法則: Kc ⇒ 各反応に固有の値で温度のみに依存
Ex. N2 + 3H2 ↔ 2NH3, Kc = [NH3]2/([N2][H2]3) (一般に)平衡成立状態の条件を変える → 影響を打ち消す方向に平衡が移動
Ex. 平衡系 → 温度上昇 → 吸熱方向に平衡移動 1次反応 = ミカエリス-メンテン式反応速度 ∝ 濃度A → P (一次化学反応) 反応速度, v = -d[A]/dt = = k[A] = d[P]/dt
[A] = 反応物濃度, [P] = 生成物濃度 -dN/dt = kN (N: 放射性核種数), -dc/dt = kc (c: 放射線カウント数) ⇒
ln(c/c0) = -kt 大気中14CO2放射能は12.5 cpm/g(C) A. t = -1/k × ln(c/c0) = -1/(0.693/5730) × ln(8.05/12.5) ≈ 3683.6 (yr)約3639年前に作られた 濃度以外の反応速度支配条件: エネルギー状態に関係温度、光(放電、放射線)、触媒、形態(攪拌) 2次反応 (1次反応に起因)素反応 elementary reaction: A + B → P (特殊: 2A → P)v = -d[A]/dt(1) = k[A][B](2)__(k ≡ 二次速度定数) (1) 消費速度 consumption rate ↔ (2) 生成速度 formation rate 両辺を積分: t = 2.303/(k[A0][B0])·log{([B0][A0])/([A0][B])}絶対反応速度論 absolute kinetics1973 Hochachka & Somero: 海棲動物の比較研究からΔG≠ が問題と主張
E: 見かけ上のエネルギー
ΔS≠ (Kcal) ΔG≠ (Kcal/mol)
V = CTe-ΔH≠/RT·eΔS≠/R (Eyring式) ⇒ |
|
1902 Henri V: 酵素飽和現象発見 酵素触媒反応速度 = 化学反応速度論一般原理(ミカエリス=メンテン式)を概ね適用可能 → 基質による飽和度の違いが酵素反応独自の特徴として存在 酵素反応の速度論的特徴 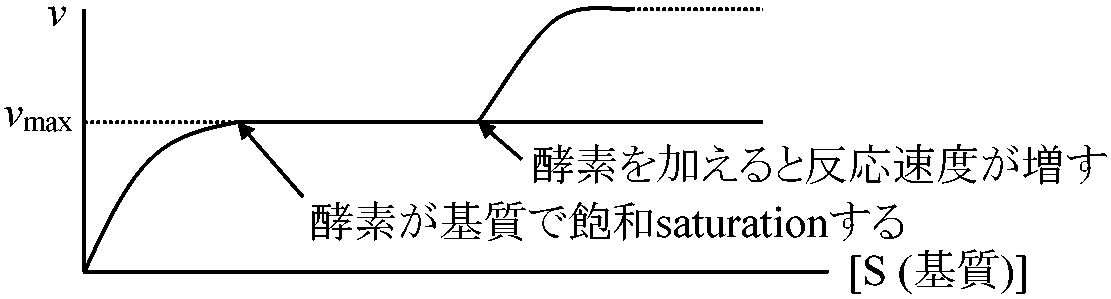 酵素と基質が結合するには両者が衝突せねばならない。衝突するとある確率で結合し酵素基質複合体となる。基質量が少ない時には複合体は衝突頻度に比例し、基質量に比例する。基質濃度が酵素濃度に比べ過剰の時には、全ての酵素は複合体で存在し反応速度は基質濃度と無関係である 最大速度 maximum velocity: 酵素が基質飽和状態で示す反応速度 1913 Michaelis-Menten 反応数学的解明 (Gibbs GE, Halden JBSら補正)____k+1 (1)_____k+2 (2) E___⇄___ES___⇄___E + P ____k–1_______ k–2
[E]: 全酵素濃度 total enzyme concentration
[S] ≫ [E] Mb, Hbの反応は酵素反応として等価 - 酵素反応モデルとしてよく使用 定常状態 steady state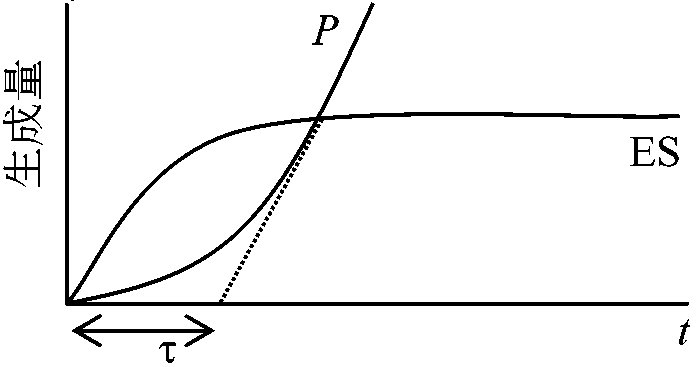
dP/dt = constant Def. KM: Micaelis-Menten constant (ミカエリス-メンテン定数)
[ES] = ([E][S])/(KM + [S]) … (7) Vmax/2 = Vmax[S]/(KM + [S]) ∴ KM= [S] 親和性を表す |
Def. KM: 酵素基質親和性 enzyme substrate affinity
KM小: enzyme substrate affinity 大
ラインウィーバー-バークグラフ(二重逆数プロット, Lineweaver-Burk graph or plot) -1/KM ⇒ KMが求まる: 両逆数プロットdouble reciprocal plotあるいはLineweaver-Burk's plotと呼ぶ 複合酵素系生体内では、それぞれの酵素が単独で簡潔した役割を果たすことは少なく、普通は多数の酵素が互いに関係し働く。複合酵素系は、その成分酵素とそれぞれの基質が1つの反応連鎖を形成し複雑な物質変化に関与する。物質変化の反応系は普通物質交代系と呼ばれる。即ち、生体内に見られる物質交代とは複合酵素系によって触媒される物質変化過程である
I型: A → B → C → D → BX + C → B + CX (ex. 酸化還元反応、電子伝達系) 基質とそれぞれの酵素についての存在量と活性が関係するが、その他に幾つかの因子を考える必要 表. 酵素反応速度を支配する諸要因とその研究から知りうること速度を支配する因子(1-3 分類 → 要因): その研究から得られる知見 1 濃度因子 →
酵素濃度: 反応機構
温度: 速度パラメータの物理的意味など 基質及びエフェクターの構造: 基質やエフェクターと酵素の結合性質、酵素活性部位構造等。分子構造と親和力との関係の系統的考察 |
|
阻害部分: ① 酵素触媒の機構・経路、② 酵素基質特異性、③ 活性部位官機能の性質、④ 酵素、分子の特異なコンフォメーションの維持に関与する特定の官能基の性質、等 阻害様式 = 可逆阻害 (拮抗阻害 + 非拮抗阻害) + 非可逆阻害可逆阻害 reversible inhibition拮抗阻害 (競合阻害, 競争阻害) competitive inhibition酵素が厳密に1つの基質を選ばないため阻害剤・基質が共に同じ活性部位active siteに対応 → 結果として基質が活性部位に結合できないVmaxに達する時間延びる ⇒ Vmax値に影響ないがKM値が変わる Ex. 1. コハク酸脱水素酵素 succinate dehydrogenase
コハク酸succinateが脱水素を受けフマレートfumarateに変わるときにフマール酸を混入するとコハク酸の脱水素反応がにぶる
____k+1
化膿菌増殖に必要なパラアミノ安息香酸類似物質で拮抗阻害物質として効果 – 助酵素結合部に構造の良く似たスルフォンアミドが結合し酵素作用がなくなる 非拮抗阻害 noncompetitive inhibition阻害剤と酵素は基質と無関係に可逆的に結合しVmax減少しKMは変化しない。即ち、基質と酵素の親和性に影響がないが、みかけの酵素量が不足する
Ag+, Hg+による阻害 基質-酵素複合体がさらに基質と結合し不活性化 - 高基質濃度が逆に阻害効果をもたらす 不競争阻害 uncompetitive inhibition阻害剤が基質-酵素複合体にのみ結合 非可逆阻害 irreversible inhibition酵素分子の官能基を永久的に化学修飾するEx. Iodoacetoamide
ICH2CONH2
|
調節酵素 control enzyme or regulatory enzyme酵素中でも特殊化した代謝調節上で特別な役割を果たているものアロステリック酵素 allosteric enzyme 共有結合性変調酵素 co-varientry modurated enzyme アロステリック酵素 allosteric enzymeアロステリック効果を示す酵素の総称1961 ジャコブ、モノー(1968 オペロン説でノーベル賞) (1) アスパラギン酸トランスカルバミラーゼAspartate transcarbamylaseはピリジンヌクレオチド合成経路の初段階酵素であるが、これが合成経路の最終産物であるシチジン3リン酸(CTP)によってフィードバックfeedback阻害される。基質はアスパラギン酸とカルバミルリン酸であり、CTPとはCTPは基質と立体構造上まったく異なるmean allosteric
⇒ CTPは基質と独立に異なった部位に酵素と結合して構造に変化をおよぼし酵素作用を低めたと考えた (3) 前述のアスパラギン酸トランスカルバミラーゼの反応速度やヘモグロビンの反応速度のプロットはS字曲線となる。この現象をホモトロピックなアロステリック効果という (cf. ヘテロトロピック) 上記(1)-(3)のうち(1)(3)、特に(3)の定義に対応する酵素をアロステリック酵素と呼ぶことが多い。→ 最終産物に阻害される酵素 Ex. アスパラギン酸カルバモイル転移酵素 (Aspartate carbamoyltransferase, aspartate transcarbamoylase or ATCase)
(Asp + carbamylphosphate → carbamyl aspartate) ┗ RNA ━━━ [核酸前駆体]
v = Vmax[S]n/KM[S]n (n = 1のときミカエリス=メンテン式成立)
図 (allosteric enzyme酵素反応の解釈): n = 1の方がより大きな基質濃度の変化がある。60°C, 30 minの熱処理をするとCTPを加えても通常と同じ曲線を描き、CTPの影響がみかけ上なくなるが実際はCTPと酵素は結合しており酵素がサブユニットに解離するためCTPと酵素が結合しても基質と結合するサブユニットは何の阻害も受けなくなったためと考えられる → アロステリック酵素サブユニットと結合し触媒作用をする活性部位と、この反応の制御部位が別な部分にある酵素である
v vmax 0.1 S0.1 共有結合性変調酵素 co-varientry modulated enzyme他酵素作用で活性-不活性形間を相互転化させる酵素Chymotrpsinogen → Chymotrpsin: 4個のアミノ酸がとれる(立体構造変化) Lysozyme MW 14,000 Alexander Flemming発見: 自分の鼻汁中にバクテリア増殖を阻害する物質があることを発見した。これが現在知られているリソゾームである。62番目のTrpがわずかに移動し糖ポリマーが変形し切れる熱に弱いのは立体構造の変化のため Q. 次の式で示される反応の速度式を導き、1/vと1/Sの関係を図に示せ
______→k1→___________Ki_________Ki E: enzyme, S: substrate, I: inhibitor, k: rate constant, K: equilibrium constant (a) Ki = ∞, (b) Ki = Ki'の(a)(b)の場合について解き、阻害形式を説明せよQ. vとSの関係がシグモイド曲線で示される反応は、アロステリック機構で説明される。この反応はどのような仮定に基づいて解かれているか。仮定を示せ |
|
[ 消化器系 ] 消化酵素 digestive enzyme炭水化物デンプン____アミラーゼ_____________マルターゼグリコーゲン →→→→ 麦芽糖 maltose →→→→ ブドウ糖 ______(唾液 saliva・膵液)__________膵液・腸液 アミラーゼ amylase: 可溶性デンプン、グリコゲン等、一般にα-1,4-グルカンに作用し、α-1,4-グリコシド結合を加水分解する。最終産物はマルトース・グルコース α-amylase = 動・植物、細菌 β-amylase = 植物、細菌 ___________サッカラーゼショ糖 glucose →→→→ ブドウ糖 _____________(腸液)__果糖 _______________ラクターゼ 乳糖 saccharose →→→→ ブドウ糖 _______________(腸液)__ガラクトース 脂肪 (lipid)_____リパーゼ脂肪 →→→→ 脂肪酸a + 脂肪酸b + 脂肪酸c + グリセリン _____(膵液) タンパク質 (protein)______プロティナーゼ*_____ペプチターゼタンパク質 →→→→ ペプチド* →→→→ アミノ酸 ペプトン peptone: 主にペプシンや酸の働きで,タンパク質がアミノ酸になる途中まで分解されたもの
水・酸・アルカリに可溶
ペプシン、トリプシン、キモトリプシン等 -各々が特定アミノ酸結合を切る
ペプシノーゲン → HCl、既にあるペプシン → ペプシン 加水分解酵素尿素分解酵素アルギナーゼ (肝臓): アルギニン → オルニチン + 尿素 ウレアーゼ: CO(NH2)2 + H2O → 2NH3 + CO2 核酸分解酵素 ヌクレアーゼ: ヌクレオチドを糖、塩基、リン酸に分解 アデノシントリフォスファターゼ (ATPase) (筋肉): TP → ADP + リン酸 酸化還元酵素酸化酵素チトクロームオキシダーゼ (好気性生物) cytochrome oxidase
チトクロームに伝達されたHをOと結合 フマル酸デヒドロゲナーゼ (心筋): コハク酸 → フマル酸 + 水素 アルコールデヒドロゲナーゼ (発芽種子): アルコール → アセトアルデヒド + CO2 分解酵素 カタラーゼ (赤血球・肝臓): 過酸化水素を分解し酸素と水にする その他除去酵素デカルボキシラーゼ: CH3COCOOH → アセトアルデヒド + CO2 カーボニックアンヒドラーゼ (酵母・細菌・高等植物): H2CO3 → H2O + CO2 転移酵素 トランスアミナーゼ (肝臓): アミノ酸から他のアミノ酸を作る フォスフォリラーゼ (筋肉・肝臓): デンプンやグリコーゲンにリン酸分子を加えて[ブドウ糖 → リン酸]を作る 合成酵素 タンパク質合成酵素: ATPエネルギーを用い合成作用促進 異性化酵素 リジンラセミラーゼ: 分子内化学構造を変え異性体にする |
制限酵素 restriction enzyme, REase2本鎖DNA塩基配列特定部位の内部か近くを切断する酵素
Eco RI -G ↓AATTC- λファージ 5ヵ所、SV40 DNA 1ヵ所 DNAリガーゼ (DNA連結酵素, DNA ligase or DNA joining enzyme)1967 Gellert M, et al.: E. coliから発見 → DNA複製・修復・組換に必須
2本鎖DNAの片方の鎖の切断部(隣接する3'-ヒドロキシ基と5'-リン酸基)をホスホジエステル結合させる 制限酵素 + 連結酵素 → 組換DNA 実験 (experiment): 酵素反応(唾液アミラーゼの作用)目的 (objectives): アミラーゼを用い、生体触媒である酵素の性質を調べる方法 (methods)
Ref. ヨウ素デンプン反応
デンプン アミロース アミロペクチン 限界デキストリン グリコーゲン 酵素濃度と酵素活性反応条件: pH, [S], 温度, 時間 (10分)を一定にし、[E]を変え実験 反応組成
Blank D0  a → 濃すぎ ⇔ c → 薄すぎ。実験IIは酵素活性5-7位の酵素濃度がよい(実験II反応組成、酵素液*) 酵素反応とpH (最適pHを求める)反応条件: pHのみを変え、他条件変えない反応組成
実験結果: 表及びグラフを書く 試験管番号 1 2 3 4 5 6 7 8 9 基質液 2 2 2 2 2 2 2 2 緩衝液 pH 5.0 1 5.5 1 6.0 1 6.5 1 7.0 1 1 1 7.5 1 8.0 1 0.1 M NaCl溶液 2 1 酵素液 1 1 1 1 1 1 1 1 計 4 4 4 4 4 4 4 4 4 酵素の熱失活上記実験に加え、恒温水槽内にて60°Cで30分処理を行ったもの |
1. oxidoreductases (酸化還元酵素)EC1.18.6.1: ニトロゲナーゼ (N2固定酵素) nitrogenase大気中窒素をNH3に変換する反応触媒 (窒素固定行う細菌が持つ) 複合体が反応触媒: 2つのタンパク質からなる ニトロゲナーゼ2量体(活性中心) + ニトロゲナーゼ還元酵素 酵素活性: O2ガスで破壊 → 好気性窒素固定菌は酸素ガスから守る機構発達遺伝子nifH: ニトロゲナーゼ還元酵素nifD: ニトロゲナーゼ2量体αサブユニット nifK: ニトロゲナーゼ2量体βサブユニット |
2. transferases (転移酵素)EC 2.6.1: トランスアミナーゼ transaminase= アミノトランスフェラーゼ aminotransferase = アミノ基転移酵素 3. hydrolases (加水分解酵素)4. lyases (分解)EC 4.3.1.24: フェニルアラニンアンモニアリアーゼ (PAL)5. isomerases (異化性酵素)6. lygases or synthetases (合成酵素) |