(2026年2月10日更新) [ 日本語 | English ]
HOME > 講義・実習・演習一覧 / 研究概要 > 小辞典 > 発生学
発生学 embryoology胚(embryo)の発生を研究
動物: 誕生や孵化前 動物発生学 (animal embryology) ☛ 解剖学 植物発生学 (plant embryology) ☛ 解剖学 ≈ 発生生物学 developmental biology
s.s. 個体発生(受精から成熟個体になる過程)を明らかとする 植物発生生物学 (plant developmental biology) ホメオボックス homeoboxホメオティック突然変異 homeotic mutation: Drosophila |
体の一部が他の部分に変わる突然変異 発生調節に関連する高相同性のDNA塩基配列 Def. ホメオボックス遺伝子: ホメオボックスを持つ遺伝子 - ホメオボックス遺伝子ファミリーを構成
≈ 180塩基対 多くの動物で共通 |
|
Def.: (個体)発生 ontogeny: 受精卵から新個体が決定されるまでの過程 胚 embryo: 受精卵 → "胚"である期間 → 新個体 新個体: 受精卵から分化進行 → 自分で新個体とし養分とり生活維持 進化 vs 個体発生配偶子(精子)形成期 spermatogenesis: 卵形成 oogenesis (2n → n) = 減数分裂 meiosis増殖期 proliferation period 卵原細胞 oogonium(pl. -a) (2n): the female gametangium which produces an egg or eggs 成長期 growth period: 卵母細胞oocyte – 卵黄yolk 成熟期 maturation period: spermatozoon: spermioteleois (or spermiogenesis)受精 fertilization 卵割 cleavage or segmentation: 細胞分裂 |
Ex. 鰓gillの発生
脊椎動物: 一生水中 – 呼吸器官。陸上 – 成体には無いか分からない
発生: 幼生larva – 脳: 脊椎、脊索 = 脊椎動物に近縁 |
|
= 卵・精子形成 卵子 ovum / 精子 spermatozoon: 親からの形質を受け継ぐ – 直接観察無理 → 新個体発生に伴う情報獲得
形質的特徴に結びつく形で入っていない = 暗号の形で入っている 精巣・精子 testis and sperm第1精母細胞(2n) → [減数分裂] → 精細胞(4個) → [変形] → 精子(4個) (n)精子 sperm形は種により異なる、殆ど核のみ。養分殆どないが運動力がある1) 頭部 sperm head
セリトリ細胞 seritoli cell – 脊椎動物には必ず存在(昆虫ではない) 3) 尾部 基本片: 同じ太さ - 終片: 先に行くに連れ細くなる 通常中間期の精子 spermatid on ordinal interphase
→ H2Oを失い核が小さくコンパクトになり運動性が増す 卵 egg大型(発生初期に必要な養分を含む = 卵黄 yolk)、運動力はない
リボゾーム: basophilic。卵子形成過程でよく染色される = RNA増加 卵細胞質 organization of egg cytoplams卵内部: 宙ぶらりんで、ミトコンドリア、リボゾーム等が浮遊し、原形質流動、遠心分離等で簡単に動かせる卵表面: ゲル状gell。厚さ2-3 μm – 粘性あり、原形質流動や遠心分離での細胞組織移動困難 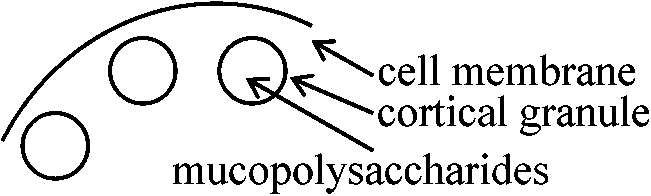
coritcal layer 一部の動物でcortical granuleの見られるものがある |
cortical granule: 大きく、ウニ0.8 μm、カエル2 μm 膜に包まれた物質で、内部にmucopolysaccharidesが含まれる 極性 polarity (卵 egg)
極体polar bodyの出るところ 卵核の変化 changes in the nucleus of oocytesvolume↑ = nuclear sap – 螺旋状になる → basic dyeやfeulgen reactionに反応しにくくなるランプブラシ – 染色体(遺伝子)活性に合う ランプブラシ染色体 lampbrush chromosome: 1本の染色体を軸とし回りに多数の細いグループ状側枝が出てランプ掃除ブラシ形をした染色体。魚類、両生類、爬虫類、鳥類、一部哺乳類の卵細胞分裂時に表れる。m-RNAが盛んにDNAを転写している部分ランプブラシの枝 = mRNA Ex. 細胞膜: 色素透過性。ブレイクレセントbreakrescentで高い – 様々な変化1985 Roux: sperm侵入部 = 陥入breakrescentの対称部位 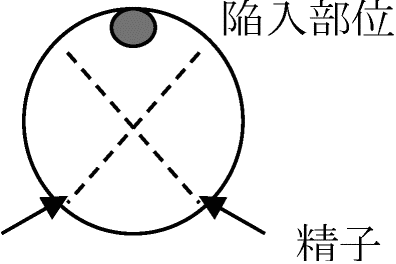
人工的に精子侵入部位を固定変化させる Exp. 卵に2つの精子が入るとどうなるか
ゼリーを外し卵の自由回転を可能にすると卵は斜上に立つ → dorsal side, ventral sideの比重が異なる |
|
精子が卵の表面につき、精子核が体内に侵入し、精子と卵核が合一して2nの核になるまで
配偶子接近 → 不可逆的接触・凝集・細胞間接着 → 細胞膜部分的融解・再構成 → 核接近接触 → 核合体 受精に関する理論 theories on fertilization
1. Fertilizin theory (Lillie FR) - negative |
交雑受精 species hybrida) foregin sperm: activative agent → perthogenesisウニ♀ × ウミユリ♂(= foregin) / ウニ♀ × イガイ♂ Cp. perthogenesis 表10.4. カエルの種間交雑雑種 (*: 未受精卵をトリプシン処理すると受精)
卵子(♀)
精子(♂)
受精
到達発
精子の行動 a, bは厳密にはspecies hybridではない c) fusion of male and female: 多くが原腸胚gastrula stageで発生を止めるd) riable hybrid adult → sterile エゾアカガエル♀ × ヒキガエル♂ → stop development at gastrula stage トノサマガエル♀ × ヒキガエル♂ → 成体まで進む(perthogenesis) 交雑受精の利点1. 配偶子融合gamete fusionが可能2. 発生段階における遺伝子活性を観察できる 生活の場と生殖法水中 = 体外受精: 雌雄とも放出する配偶子の数が多い – 受精確率が低い陸上 = 体内受精: 作る配偶子の数は少なくなる – 受精確率は高い |
卵割の速度と型が問題
卵の種類と卵割受精卵の細胞分裂 = 細胞分裂するのみで大きくならない(成長しない)等黄卵: 卵黄は少なく均等に分布 ⇒ 全割 - 等割 Ex. 哺乳類(ヒト)、ナメクジウオ(原索動物)、棘皮動物 弱端黄卵: 卵黄がやや偏る ⇒ 全割 - 不等割Ex. 両生類(カエル、イモリ)、軟体動物、環形動物 強端黄卵: 卵黄が著しく偏る ⇒ 部分割 - 盤割Ex. 鳥類(ニワトリ)、爬虫類、魚類(メダカ) 中黄卵: 卵黄は中央部に分布 ⇒ 部分割 - 表割Ex. 節足動物(昆虫類、甲殻類) Ca-free, kEDTA, trypsin, etc. →
割球blastmere: 細胞数 1 → 2 → 4 → 8 → 16 → 32 → 64 (仮定) …
→ 圧力を加えるのは卵割を思う方向に行なわせるのによい方法 核移植 nuclear trasplantation分裂した核を卵に移すホストhost (核を移植される側): enucleated egg
染色体欠損・核異常 |
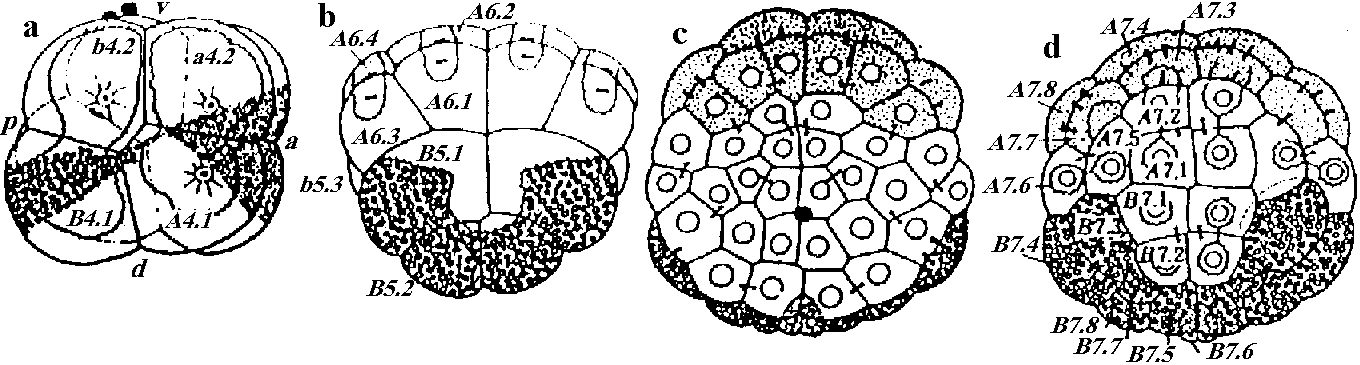 Fig. 12.4 Styela partitaの卵割。a. 8細胞期右側面。a: 前部, p: 後部, d: 背部, v: 腹部。b. 20-24細胞に進みつつある時期の背面。灰色新月環はA6.2, A6.4に含まれる。c, d. 細胞期腹、背面。A7.4, A7.8神経板、A7.3, A7.7脊索、B7.4, B7.8筋肉、他の黄色色素を含む細胞はA7.6を含んで間充織、dのその他は内胚葉を作る。Cの新月環以外は外胚葉 (Conklin 1905) Exp. Rana pipiens 卵核除去 + 精核除去 = 無核 (anucleated) → 部分割 parted cleavage Exp. 卵核のみ除去 = androgenetic haploid → ある程度発生⇒ 核の部分的存在はある程度の発生を保障 → 核の質的な問題が残る 非対称性 (asymmetric property)1928 Spearman第一卵割前に毛髪で卵を束ね、16細胞期以前に片方有核、もう片方は無核のものを作る → 各々正常発生 1968 Gurten: "核においての発生のための細胞能力は変わっていない"1969 Lepori: アヒル卵黄の胚盤葉を様々に切断し双生児を作る – 内蔵の位置はほとんど全てで正常 1976 Morgan: 基本的(非)対称性は第一または第二卵割の段階で表れる
= 遺伝子情報ではなく、細胞質の情報によると考える 極葉 polar lobe of dentalium= 軟体動物卵が初期卵割時に植物極側に作る細胞質のコブ
第一次極葉(核含まない細胞質、頂毛をコントロール) Regulated gene → [inhibition] → Structure gene 1dではこれが働き阻害解除され頂繊毛が形成される |
外胚葉 ┬体表の外胚葉─┬─┬─────────眼レンズ、耳胞 ectoderm│ │ └───────表皮、毛、爪、汗腺 │ └────口腔上皮、臭上皮、表皮、内耳 ├神経管─────眼胞───────眼盃─網膜、水晶体 └神経冠(神経管背側外胚葉)───┬─感覚神経、交換神経 └──────色素細胞 中胚葉 ┬頭部の中胚葉──────────骨格、循環系、排出器 mesoderm├脊索─────────────────────(退化) │ ┌────硬節───────────脊椎骨 ├体節───┼────筋節───筋肉(横紋筋)、手足骨格 │ └────皮節────────────真皮 │ ┌──────────────────腎臓 ├腎管───┼────ウオルフ管────輸尿管、輸精管 │ └────ミューラー管───────輸卵管 └側板───┬─外側板───────腹膜、腸間膜、脾臓 └─内側板──┬─────平滑筋、結合組織 └─────心臓、血管、血球 内胚葉 ┬腸管前部─┬────鰓穴────────────中耳 endoderm│ ├───────────肺、気管(呼吸器系) │ └──┬───食道、胃、十二指腸(消化器系) │ └────────────肝臓、膵臓 ├腸管中部────────────────────小腸 └腸管後部───┬────────────────大腸 └────────────────膀胱 生殖腺発達 development of gonad1. 始原生殖細胞の起源 origin of primordial germ cell (gamete)脊椎動物: lateral – visceral layer → germinal ridgegerminal cellとかなり離れたところから移動をしてくる - 切片観察するとよく分からない 鳥類・爬虫類では特殊な型なので分かる → mesodermのsegmentation前にendodermに表れる
これを破壊してみる(熱した針により焼く) Ex. Amphibian: gastrulaまでoriginを追跡可 – アメーバ運動で移動している?
1) 石英スライド: 卵は潰さない + 動物極を上 260 nmのUV(RNA阻害)を様々な角度から照射 → 植物極からあてた時、gonad中にgerm cellがなくなる 2) 毛細管等で吸ってやる: Rana等ではすぐ傷が塞がり発生する 毛細管等で吸ってやる: Rana等ではすぐ傷が塞がり発生する3) Xenopus: normal (black) / albino (white)
[ 動物細胞遺伝学 ] 2. 性分化 (sex differentiation)Bufo: Bidder's organ = indifferent gonadprimary germ cellの位置が、卵、精子の決定因子となっている 肢対の発生 development of paried limb幾つかの起源originがある側板lateral plateのsomatic layer近くに位置
mesodermと表皮がlimbになる |
limb budの部分には、かなり早い時期からoriginがある – 移植実験等により証明された ⇒ 神経管が閉じた時点で足の決定(中胚葉による)はされているが、表皮はまだ決定されていない Amniota (有羊膜類)
(ectodermal) apical ridge – RNA-rich, glycogen-rich, alkaline phosphatase (optimal pH = アルカリ) → 足の発生は起こるが先端ができない Amphibia: apical ridgeなし – どこから持ってきても普通に足ができる
ニワトリのlimb bud (= 翼芽wing bud)をトリプシン処理するとectoderm(健全)とmesoderm(変性)を分離できる
Ectoderm: W, L / Mesoderm: L, W → 必ずmesodermによって決定される = 中胚葉依存
Amphibian: 前足/後足は、その部位がどちらに近いかで決定される - かなり離れた所でも形成される 初期胚 (pre-embryo)割球分化能力Hörstadius 1931, 1935, 1939, 1949: sea urchin
16細胞期
中割球 → 外胚葉
卵軸に沿って2分 → 小さいが完全なプルテウス幼生 桑実胚(morula) – ここまでは縦分裂では正常発生、横分裂では異常発生 赤道下部で直角に2分 → 植物極側 = 巨大exoderm and gut = extogastrula ⇒ 全てがend, meso, extodermを有するのか? 両生類の生殖質 germplasm in amphibiansPGC/mutantによる研究1970 Buehr & Blankea: X. laevis
UVC (253.7 nm)照射 → 0, 1/4, 1/2, 3/4, 1 – 照射面積 1966 Smith: Rana pipens
230, 254, 278, 302 (nm) UV – 254 nm is the most effective = 1つのPGCも形成されない
237.5 nm – PGCをある程度形成 |
|
嚢胚(原腸胚)gastrula: 原口背唇から最初陥入する細胞群は、口、咽頭のendodermになる。続いて入るmesodermは一部頭部結合組織になる以外は大部分背側で脊索になる。原口背唇及び腹唇から入るmesodermは脊索両側に集中する傾向を示しつつectoderm, endoderm間を前方へ移動する。v.p.から遅れて陥入し原腸床を構成するectodermは中腸、後腸になる。mesoderm, endodermが胚内部に入り込む頃までに予定神経系組織は著しく縦に伸び背側表面を占め、同時にその他の胚表面は広がった予定表皮細胞により覆われる
unfertilized egg (♀n) + sperm (♂n) → fertilized egg (1 cell, 2n) 嚢胚形成の特徴 characteristics of gastrulationblastulaと本質的に異なり、つまりblastulaまでのDNA合成が異常に早く(E. coliと同程度)、ここから普通の体細胞(最良の条件でも10数時間)に近くなったと観られる1) 細胞再配置 rearrangement of cells
形態形成運動morphogenetic movement = cell metrication 単なる細胞増殖だけでなく移動能力有
背-腹 / 左-右 / 前-後
a) 細胞分裂 ↓
b) DNA合成 ↓
c) RNA合成 ↑ gastrulaを越えるとまた自律的に形態形成が進むことが多い Exp. 異種の精子で受精 → blastulaまで進行し、gastrulaで成長停止
ウニ sea urchin受精卵 ⇒ 2細胞期/縦裂 ⇒ 4細胞期/縦裂 ⇒ 8細胞期/横裂 ⇒ 16細胞期/動物極 = 縦裂、植物極 = 横裂細胞間接着能力が衰える 桑実胚 morula胞胚 blastula: 胞胚腔 blastocoel + 胞胚葉 blastoderm
anus: 閉じずにそのまま1回閉じてまた開く 嚢胚 gastrula2つの過程1° half: vegetative plate cellsへの陥入
嚢胚形成初期に植物極板の数細胞が胞胚腔側(内壁)で相互の接触を失い、胞胚腔に脱出してくる。遊離した数10個の細胞は枝分かれのある長い糸状仮足filopodiumを出しながら細胞腔内壁に沿って移動し、後壁の一定の2ヶ所に集まって定着する。これが16細胞期の4個の細胞に由来する。一次間充織(primary mesenchymal) cellであり、後に骨片を形成
糸状仮足filopodia: 接触により自分の行方を探す。口の部分を認識し接合し仮足部が縮んで更に陥入 両生類 amphibians
材料: イモリ初期嚢胚 – 発生はカエルとほぼ同じ |
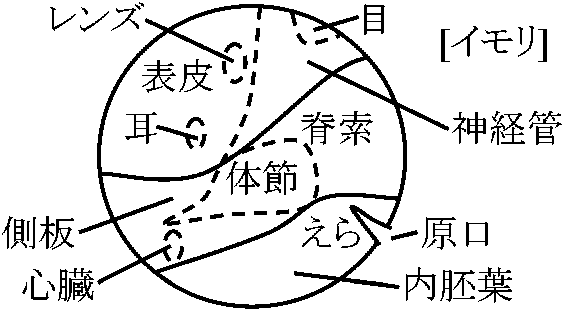
染色された部分がどのような器官、組織になるかを観察 → 胚に記入 = 胚発生予定域図 fate map 発生受精卵: 弱端黄卵(全割不等卵)→ 2細胞期 → 4細胞期 → 8細胞期 → 16細胞期 → 桑実胚 morula嚢胚
絶えず細胞が移動。原口の縁を作っている細胞は刻々と変化している。背唇 dorsal lipへの細胞陥入が著しく激しい。統一的に細胞集団が移動しており、個々に動く細胞はない – 生体染色によりわかる
× 減数分裂, ○ 細胞形態変化 ▉▉▉▉ 胞胚末期 → ▃▃|▃▃|▃▃|▃▃ 嚢胚 3. 巻込 involution
瓶細胞 bottle cell形成 (= 細胞形の変化change in cell shape)
⇒ 嚢胚形成期には卵は陥入能力を有する。その後暫くこの能力は維持される
前期 魚類体の背方向の器官に発生すべき部域が胚盤の一端、即ち後端に集中
内胚葉と中胚葉の陥入は、胚盤の回りを取り巻いて起こるが、上皮層が内部へ押し込まれることなく、原腸も形成されない 鳥類1. 胚盤葉上層epiblastと内胚葉hypoblast分離
将来の胚の後半部に向かって明域上層細胞が正中線に向け集まり帯状の肥厚(原条primitive disc)を作る。原条中央に溝が生じ、ここから内部に落ち込む細胞が中胚葉、内胚葉になる(葉裂delamination) – 陥入ではあるが、細胞が列をなし落ち込むため葉裂と呼ぶ 原条前端中央から細胞落ち込みが活発に起こり、移入細胞は側方ばかりでなく前方にも移動して脊索を作る。相対的には発生が進むにつれ後ろに下がり、これがヘンゼン結節である 哺乳類とほとんど変わらない哺乳類 (mammal)基本的には鳥類と同じ |
体の分節性生じる - dorsal側に強く、ventral側に行くにしたがって弱くなる
体節 segment, metamere動物の前後軸に沿って体が多数の部分に区分され、各部分が極めて良く似た器官(系)を備え、外観からは体壁によって区分が見られる部分
1. 中胚葉性体節 true or mesodermal segment 神経組織誘導 neural induction誘導に関する一番始めの知見は神経組織において知られた 神経中葉胚: 神経管 neural tube → 脳 brain, 脊髄 spine |
両生類初期嚢胚を取囲む卵の黄膜(jelly含)除去し胚を裸にし1/16 M NaCl中に浸す → 原口から陥入するはずのendoderm, mesodermが外側に飛び出した裏返し胚exogastrulaになる c, ectoderm: 表皮になるべき細胞 – 神経組織なく一部神経組織になるはずだった これから分かること → 予定表皮になるのは、ただ入って行くのみ出なく、伸びる性質をもともと持つ 脊索中胚葉がないと神経管になる外胚葉が神経管にならず外胚葉に留まる |
|
1918 シュペーマンSpemann: イモリ(クシイモリ、スジイモリ)
全能性 – 受精卵
予定神経域 → 表皮域に移植 → 表皮になる vs 予定表皮域 → 神経域に移植 → 神経になる b) 後期嚢胚(神経胚まで) – 原口のほぼ完成したころ
予定神経域 → 表皮域に移植 → 神経になる vs 予定表皮域 → 神経域に移植 → 表皮になる 表皮や神経の発生運命は嚢胚中期頃に決定する 1920-30 Spermann (数年前fate map完成)
形成体(オルガナイザー)発見: hair loop, glass needle, pipette使用 誘導説個体構造が一定形に誘導するもの(形成体)と誘導されるものの関係で大から小までの構造が形成される二次胚: notochord, somite, neural tube – graft origin ↔ the others – host origin ⇐ graftにより誘導(induction) 脊椎動物では不変的現象: 組織と組織が影響し分化 = tissue interaction
|
Ex. 脊椎動物の眼形成 – 一連の誘導
一次形成体 → 原口上唇部 / 二次形成体 → 眼杯 / 三次形成体 → レンズ ホックス遺伝子 hox genes: 胚形成期に主な体の部分が決まる時に働く
後生動物に広く分布 誘導特性解析 analysis for nature of induction技術 technical1930年代始-神経組織誘導誘引物質を探す試みはイモリ初期嚢胚から切り出された予定外胚葉片で活性テストされる組織をサンドウィッチにするか、同外植片をテストされる物質を含む生理塩類溶液中で培養する方法で行なわれた。この種の試みから神経組織誘導作用は同種幼生、成体の組織のみなならず、熱、アルコール等で処理された腔腸動物から哺乳類に渡る広範な動物組織に認められた。さらに、予定外胚葉をステロイド、メチレンブルー、極端なpH(5.0 < or > 9.2)に短時間晒すだけでも有効であることがわかった 異常誘導 abnormal induction1950-60: イモリ神経組織誘導する物質を哺乳類から取り出し、同定する試み[結果] 予定外胚葉を 1) 頭部神経組織に誘導する(ラット、モルモット肝臓から) 2) 中、内頭部神経組織を誘導する(マウス、モルモットの骨髄、ニワトリ胚から) 3) 胴、尾部の神経および中胚葉組織を誘導する(ラット、モルモットの腎から) ---- 等の作用を持つタンパク質性分画が取り出された。そして、これらの異なる誘導源の頭尾、背腹にわたる分布勾配により誘導される組織の特性を説明するモデルが提唱された。しかし、その機構は未詳で証拠もない Burth夫妻の誘導問題への新しい見方 = ionic regulation of neural induction
カエル嚢胚から切り出された予定ectoderm組織
未受精卵に紫外線をあてるかあるいはhair loopにより核を除去する一方、epidermの核を抜き取り合成する モザイク卵と調節卵調節卵: 発生途中で卵の一部が欠失して残された部分から完全な個体再生
発生が相当進んでから発生運命が決定される卵
発生運命が発生の極初期に決定される卵 |
|
1. 細胞形cell shape
個体発生に伴ない変化 (cf. 粘菌) i), ii) 現実に合わない
iii) regional differentiation of cell elongation: 個々の細胞伸び ≠ 均一 a) ウニ嚢胚における第1, 2間充織細胞: primary mesenchyme → bone b) ニワトリ原条からこぼれ落ちる中層細胞mesoblast c) neural crest cell d) primodial germ cell e) リンパ球前駆細胞 特定の場所にたまる – 運動を停止し定住、あるいは認識しながらの運動 3. 細胞移動様式i) アメーバ運動amoeboid movements
細胞自身が積極的に動くのではない受動的なもの
細胞が動いている方向にruffleができる(波打ち膜ruffled membrane) 細胞を含む物に触れると壊れる - 細胞増殖阻止機能を持つ(仮説) b) 接触指導 contact guidance
→→→→→ 基質にある配向によって並び方が決まる
Neural tubleができるとき、その中からこぼれおちる細胞 – contact guidanceが起こる 細胞形 cell shape両生類の予定外胚葉のepiboly → 細胞分裂による細胞数増加は関与しない個々の細胞が扁平になる 胞胚末期までより下層に位置していた細胞がいくらか割りこむ
a) 陥入する両生類の原口にフラスコ形細胞 1) 陥入する細胞が相互に緊密につらなりシートとして中に入り込む 2) フラスコ状細胞が他の細胞との接着性を失い個々が落ち込む
カエル原口のフラスコ細胞は、胚内側に面した側では偽足pseudo-podiumを出し周囲の細胞と緩く接着しているが、表側自由面では細胞膜が指状突起を出し合って陥入し、細胞どうしが電子密度の高い物質を介し強く結合している 神経化する細胞は、縦に長くなり、さらに窪みが生ずる部分では必ず細胞が円錐形になる 1967 Baker & Schroeder: 伸長が起こった細胞
a) 細胞長軸に沿って直径180-250 Åのmicrotubleが150万本並ぶ |
選別と選択的親和性 sorting out and selective affinity細胞の型: 分化により決まる = 選択的親和性selective affinity同じ型の細胞が癒合する → 器官形成: 一定の位置関係で配列 1) 細胞間接着 intercellular "legand" + cell surface receptor
cell adhesion → dissociate → reagrregate (at random) → soring out
"legend" + receptor ×aggregation 細胞の持つ受容体receptorがあるとaggregation阻害: 組織特異要因存在 = inductor作用 (in vitro) 2) 差次粘着 differential adhesiveness
粒子をコロイド状と考え、細胞同士がつく(つかない)を検討する Ex. ニワトリ脳細胞膜 8.9 d > 10 d (粘着性著しく低下) 3) 選別cell-to-cell contact and sorting out
分化した細胞の選択的親和性 selective affinity
amphibian: neural-tailbud → pH 9.6-9.8 → dissociate pH 7.3 → 再凝集 re-aggregate → 選別
嚢胚期に出現する、この組織に特異的な選別現象はMosconaらにより5-12日齢ニワトリ胚や12-15日齢マウス胎児の多組織・器官で確認
a) 解離された細胞は必ず無差別な接着(再集合)、選別という経過をたどって組織器官を再構成するばかりでなく、組織や細胞に特有の酵素活性をも示すようになる
機械的解離mechanical dissociateしたカイメン細胞 – 海水中で滅多切
CMF-SW (カイメン) → dissociate → normal SW → reagrregate 選別に対する考え方1. 細胞間物質重視(Moscona 1953-)。細胞タイプそれぞれ特異的細胞間物質が細胞相互接着の橋渡しの役目を果たす
(難点) 集合体内で細胞が特定配置positioningをとることは説明困難 (難点) 接着性の本質は何かという裏付けを欠く - 結局、細胞選別機構については不明の点が多い |
|
神経胚(神経芽細胞)neuroblast → nerve cells 1) 神経管 – brain, cord, motor neuron 2) neural crest(神経細胞のなり損ない) – sensory nerve 3) 臭覚器 cramial placodes 中枢神経系 central nervous system染色体が表れ細胞分裂が起こるのは髄腔側実際は核が動いている → 細胞が周期に従って接着性に変化 初期はエレベータ運動をしながら増殖分化していく細胞(matrix cells) matrix cells
→ neuron 脳の形の変化にも細胞増殖の影響がある neural crest cells (migratory cells)移動ルート
1) 神経管と体節の間を腹方に移動し、体節レベルで更に2つに分かれる
a) nerve cells: cranial sensory nerve, dorsal root ganglion (Schwann cell), adrenal glandの親クロム細胞 |
neural crestの追跡cell marking a) 3H-thymidine: 分裂細胞により取り込まれDNAがラベルされる - 2回の分裂で1/4に減る ラベルされたものを移植し、どの細胞型がラベルされているのかを調べる b) ウズラとヒヨコのキメラquail-chick chimera
ウズラの核nucleolus → Feulgen-positive = クロマチンが染色される
ウズラ: somite → gut asympath ganglion
28 somite stage Acetylcolinesterase分泌細胞になる Q1-6 tissue → C S18-24 = Q cellはC adrenal medulla (chromatin cells)になる 軸索成長 growth of axon成長円錐growth cone: 神経細胞よりの突起先端神経成長因子NGF (nerve growth factors): マウスガン細胞から発見された 網膜視蓋 retino-tectal relationshipoptiv vesicleの前後をひっくり返す → 肢芽limb budで同じような実験をする → またanimal p. axisができ、次にd. v. Axisができる
St. 28: nerve cellsのDNA合成がほとんど済む時期 |
上皮-間充織相互作用 epithelio-mesenchymal interactions上皮 epitelium-間充織 mesenchyme = epithelio-mesenchymal上皮 (endoderm, mesoderm) ↔ 間充織 (endoderm, mesoderm) ⇒ 消化管では、内胚葉性上皮に間充織が関連して(相互作用)各器官ができる 膵臓 pancreas: 上皮 = 原腸 endoderm / 間充織 = mesoderm
mouth ░░░░░░░████░░░░░░ anus 全分化 cell differentiation↑, 全増殖 cell proliferation↓ 2) 組織培養tissue culture: 細胞増殖を保証する場合に使う全分化↓, 全増殖↑ 1)/2) = in vivo (tissue or organ): in vivoで増殖しないものをin vitroで増殖させる条件 = 活性変化等
tissue organ in vivo → そのまま → (1) organ culture 器官培養 organ culture膵臓原器 pancreas rudiment
epithelium + mes → differentiation 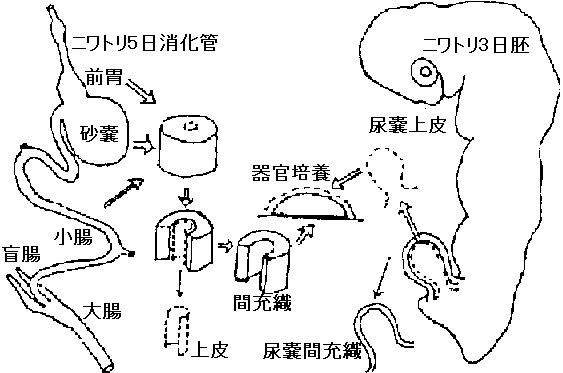 図. ニワトリ移植実験: フィルターfilter → 細胞通さないが高分子通す(transfilter method) Exp.: transfilter culture
形態的分化morphogenesis: 形が分かるhisotological(定量測定は困難。経験的な勘に頼る部分多い) |
課題:
II) protodifferentiated state (mesenchymeがあればよい epitheliumだけではある程度以上発生しない) → III) fully differentiated state (ほっとけば分化する)
教示的 vs 許容的誘導
= instructive vs permissive induction (epithelio-mesenchymal interaction) |
|
生理再生: 物質交代で新しいものと古いものが入れ替わる – 爪、髪、皮膚等 修理再生: 体の一部を失ったとき、失った部分を再び作り上げる
一般には下等な生物ほど、同種では若い個体ほど、再生力高い 代償性発達: 失われた器官の働きを残りの器官や他の器官を発達させることにより、働きをカバーする機能のこと。甲状腺、副腎、腎臓などの一部を切除すると、残りの器官が肥大して作用も活発となり、ホルモンの分泌、尿の生成などが盛んになって恒常性を維持することができる 両生類の肢再生 (limb regeneration in urodelan amphibians)有尾類: 成体でも再生可能無尾類: 成体になると再生能力が落ちる ampulation (cut) → 傷口治癒 wound healing → 脱分化 dedifferentiation bone (cartilage), muscle, blood vessel, nerve, messenchyme (connecitve tissue) 逆方向backwarに脱分化が進んでいる 筋肉: 横紋筋消える – アクチン・ミオシン消失 骨: コンドロイチン硫酸消失 分裂盛ん = free-ribosome多い = 未分化 → 再生芽形成 blastema formation: 活発な細胞再分化 redifferentiation - 脱分化した細胞が細胞分裂始める レンズ再生 regeneration of lens= Wolffian regeneration – Wolff発見イモリ類: レンズ再生 → 化生 metaplasia が確認される 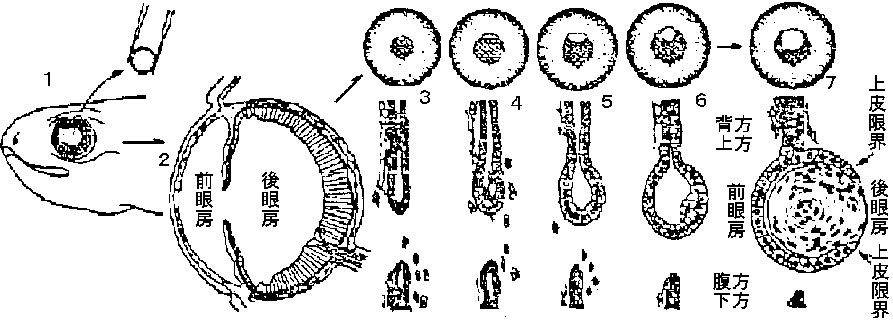
図. C. pyrrhogasterにおける虹彩からの水晶体再生過程 レンズ以外の細胞がレンズ再生: レンズ再生関与はdorsal irisの色素細胞lensecomy → thicking of dorsal iris → dedifferentiation (depigmentiation) [脱分化] → cell division &→ lens fiber formation [再分化] → redifferentiation [再分化] [limb budの分化と再生の関係]: 再生時、一度後退し脱分化起こし分化始まる 全体としてみれば、分化と再生の進行方向は同じ 可能性
|
結論 a) blastema = local origin: 傷口の持つ情報によってプロキシマルな部分が再生に関与 b) 再生能力: labeled by 3H-thymidine
2n足骨除去 → 3n骨埋め込む(挿入) → 切断 amputation → 再生 → 再生骨 → 再生体 Thickingの意味細胞間の接触がlooseになること – 重要この実験はin vitroで可能になった [in vitro] ニワトリ 8th embryo → pigmented iris: clonal culture バラバラにした細胞を薄い濃度でシャーレ上にばら撒く → 何世代か分裂するとcrystallinを持った細胞ができる = "lentoid body" in vivoではdorsal irisに限られたが、in vitroではどこでもよい レンズを抜き取るときdorsal irisとレンズの間の非常に密接な連絡が物理的に壊されてしまう Cf. イモリ成体 → 1個の細胞が転がしてlens cellになることが確かめられた⇒ in vitro実験からiris以外でもレンズになりうることが証明された cyto-differentiation ゲノム -■■■■■---------------- クリスタリンタンパク質遺伝子: レンズ再生時にここのみ活性化 細胞のタイプごとにdifferential gene expression (細胞質の因子の違いが遺伝子活性の違いを決める?) 下等無脊椎動物の再生 regeneration on lower vertebratesプラナリアplanaria: "新生細胞neoblast" or formative cell
内胚葉と外胚葉の間にある intorstitial cell – 刺胞cnidoblastの供給をはかる
_ → nerve cell, germ cell____________________ ⇒ 外胚葉 I-cellという特定の再生用細胞を用意してあるから再生力が強いというわけではない |
巨大染色体(多糸染色体、唾液腺染色体) giant chromosome双翅類等の昆虫類の唾液腺にある染色体を呼んだが、食道、腸、マルピーギ管、神経細胞等にも存在知られ、巨大染色体(多糸染色体)と呼ぶようになった
有糸分裂で見られる染色体の形、大きさと対応している パフ現象 puff染色体上で他部分と比べ異常に膨らんだ部分発生時期は組織により異なり、同一組織でも時期によって違う。さらに器官によって一定の場所に一定の順序で起こるものもある。パフはDNAが相同部位で固く密着していた染色体の一部がほぐれて膨らみ細い糸状に見える部分である。黒い縞模様の部分はDNA密度が高い。真正染色質部分は、DNAがややほぐれたところである。パフ現象は、その部分のDNAに活性化が起こっていることを示し、盛んにRNA合成が起こっていると考えられる DNA活発化 → mRNAを合成している = パフ周辺にmRNA集中している RNA合成: DNA → RNA → protein32P → 4-8 months → ovulation/fertilization → eggoogenesis間に合成されたrRNAは卵分裂の間に作られる DNA複製は全く別の過程
哺乳類では卵割初期からrRNA合成が行なわれている RNA合成調節因子 – cytoplasimc factorsExp. 14C labelling
Blastula dissociated cells → × 熱に安定な低分子 – 遺伝子との結合特異性(転写抑制)が考えられる Exp. 核移植実験 – 未受精卵に核を入れる= micro-interjunction タンパク質合成 protein sysnthesisoogenesis – [異なるRNAを合成: 直接的遺伝子測定] - tail buda) 初期発生過程で細胞分化に関与する特定タンパク質に注目するのは困難 嚢胚-外・中・内胚葉: 機能的に区別される – バラバラにする – 分別sorting out b) 後期胚、成体における特定のタンパク質を産する器官に着目するのは容易Hb – eryhrocytes, Fibroin – silk gland, Ig – lymphocytes, etc. Exp. ウニ・カエル1) encleated cytoplasm
遠心 → a) 有核__________← タンパク質を測定比較
Actinomycin D (AMD) treatment: gastrulationが起きない(それまでは正常発生)
受精直後のタンパク質合成: AMDに非感受性 |
2) maternal mRNA ウニ: infertilized egg – templateとなり得るのは数%
unfertilized egg: no protein synthesis / fertilized egg: protein syntesis
AMD treatment → 胞胚 / No treatment → 胞胚 (Cf. newlyなものにもhistoneに対するものがある = 二重保障) ヒストン histone: 分離し易い。同定可能。塩基性 扱い易いので偶々使っていたらmRNAが引っかかった。他のタンパク質は調べられていない "Maternal mRNA"として、これまでに同定されたもの
histones, microtubles, ribonucleotide reductase = 細胞分化というよりはhouse-keeping的なもの
→ meternalである証拠 (溶けて平べったくなる) ウニ: 酵素 – 孵化1, 2時間前
細胞顆粒内に活性 → 可溶性部分に移行
孵化するのはtail budだから / 雑種の分泌顆粒: EM的に見てもpaternal effectは見られる
"O"突然変異 "O" mutant on Axolotl - Ova deficient
ウニ: unfertilized egg, x% (usually 2-3%) template |
performed maternal mRNA – translotionでの調節↔ post-transcriptionalな調節が細胞分化には一般的? – 断定できない[method] injection – 直接に卵のtranslation能力を観察する [recipient] Xenopus, oocytes (full grown) φ 1.2 mm ホルモンによって排卵される寸前のもの。1ヶ月位培養可能 GV中に直接injectionする - trace m-RNA, nucleus, DNA1) mRNA injection: 発生の進んだ卵にmRNAをinjection
その後oocyte – 上方が与えられれば無差別に利用 |
mouseではα:β = 8:10 (細胞内でのregulation) → oocyteではα:β = 2:10 ⇒ + hemine: 8:10に近くなる
Hela cells → 5 oocytes (assayに十分) + 14C-AA
意味のある塩基配列はどの位か |
|
生体防御 bioloical defense: 外敵から身を守る方法の総称 1) 物理的・化学的 physical and chemical Ex. 皮膚 2) 細胞的・生物的 cellular (or biological) – non specific
食作用 phagocytosis: 原核生物では栄養摂取に用いられる
体内に抗体antibody形成 → 抗原antigenの体内侵入時 → 速やかに抗原抗体反応 → 抗原より作り出される病的症状が消失か減少
a) 特異的 specific
高等生物: 106以上の種類のAbを作りうる → いかなる抗体を生産するか 体液性免疫: 抗体(IgM, IgG, IgA, IgE, IgD)による体液中の抗原排除
Ex. 免疫抑制剤 immunosupressor: 細胞性免疫を抑制 先天免疫と後天免疫a) 先天免疫: 生まれた時から持つ免疫 – 種が進化過程で獲得 Ex. 血液型b) 後天免疫: 生まれてから抗原との接触により作られる免疫 自動免疫(能動免疫): 自己体内に抗体を作る
病後免疫: 病気等により抗体を作る 他動免疫(受動免疫): 他の生物の抗体をもらう
血清療法: 他の動物に抗体を作らせ、抗体のできた血清を接種することにより一時的に免疫を得る。速効性だが、長持ちはしない。Ex. ジフテリア、蛇毒、破傷風、ワイル病 アレルギー症のときに血液中のヒスタミン増加が観察されること、抗ヒスタミン剤により症状が抑えられることから、抗原抗体反応の結果生じたヒスタミンが種々の異常現象を引き起こす原因と考えられる Ex. ツベルクリン反応(ツ反): アレルギー反応利用 → ヒト型結核菌を加熱滅菌し、濃縮菌体を濾過し2000倍に希釈して人体に0.1 cc接種し48時間後測定する 抗原抗体反応 antigen–antibody reaction抗原が体内(体液)に入ると対応する抗体が血漿中に形成される抗体: γ-グロブリン (γ-globlin, ) (抗体タンパク質)が変化したもの → 抗原に特異的に反応し(= 抗原抗体反応の特異性)、細菌等の融解、凝集、タンパク質凝固(沈降)、毒素無毒化、血球凝集等を起こす一連の反応
沈降線の出来方: X, Y = 抗原、x, y = 抗体
*: 抗体を作らせる物質 - 非自己物質 = 異種タンパク質、多糖類、核酸等 抗体産出生成の場: リンパ系の組織(脾臓、リンパなど)に集まっている抗体産出細胞(プラズマ細胞)により行われる ⇐ プラズマ細胞: 白血球の一種(骨髄 → 胸腺細胞) 生成の仕組み: 抗体が形成されるとき他のいくつかの細胞が関係する
B細胞: 骨髄由来。抗体産出細胞に分化する 液性免疫反応(応答)humoral immune response分類 classification:
1) humoral 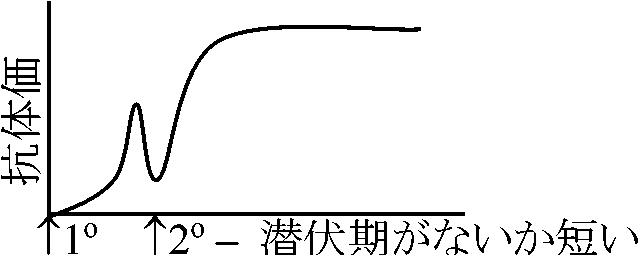 1) 1° and 2° responses
1) 1° and 2° responses
抗体価測定方法: 血清反応がみられる低濃度限界を計る Ex. 倍々希釈 2-1, 2-2, 2-3, 2-4, etc. 10倍希釈
a) 凝集 agglutination "抗原性"の条件1. macromolecule (minimum = mw 10000)2. 非自己タンパク質 non-self = foreing of the living thing 3. 抗原決定基 antigenic determinant (epitope)
抗原としての認識部位は巨大分子中の一部の特性に基づく → 他の発生段階のものに接種すると各々の段階における特異的タンパク質が見つかる 抗体タンパク質の構造 structure of antibodies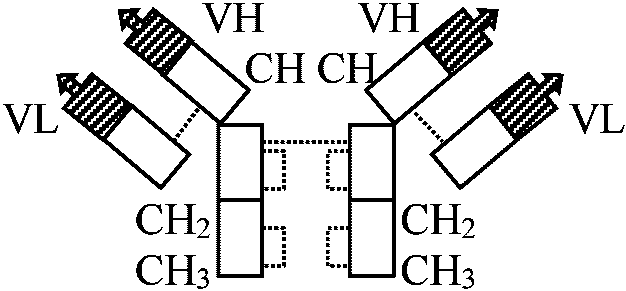 可変部: 長鎖と短鎖のそれぞれN末端側アミノ酸配列の違い(約10個) およびその結果である立体構造(エピトーム)によって特異的な抗体となる
可変部: 長鎖と短鎖のそれぞれN末端側アミノ酸配列の違い(約10個) およびその結果である立体構造(エピトーム)によって特異的な抗体となる不変部: CLは全抗体で同じ。CHはCLと同じ構造が3回繰り返され全抗体で同じ █ L鎖: mw ≈ 2.3万。214個のアミノ酸 = 不変部約100個 + 可変部約100個 ▒ H鎖: mw ≈ 5.3万。可変部約100個 Ig Classes幹細胞 stem cell
自己に対するクローンcloneもできるが、発生初期に多量の抗原により抗体は消失する クラス IgM IgG IgA IgE IgD H鎖 μ γ α ε ε L鎖 κ, λ ε, λ κ, λ κ, λ κ, λ 分子式 (L2μ2)5* L2γ2 (L2α2)1-3 L2ε2 L2δ2 分子量(×105) 9 1.5 1.5-4 2 1.8 サブクラス数 2 4 2 - - 血清中濃度(mg/ml) 0.5-1.9 8-16 1.4-4.2 <0.07 <0.4 補体結合能 + + - ? - 胎盤通過性 - + - - - 外分泌液への分泌 - - + - - マスト細胞への結合 - - - +** - * B細胞の抗原受容体としてはL2μ2。** アトピー性アレルギーの原因 下等な動物ほど抗体作りにくい – variable regionsの対応性が未形成両生類: 有尾類 – 陸に出ない / 無尾類 – 陸に出る = IgRAA (like IgG) 有尾類と無尾類の差が大きいことを示す例 抗体のエフェクター機能 effector function of Ab1) 凝集agglutiantion:
凝集素agglutinin: 特異的抗原(凝集原)を凝集させる → IgG,IgM,IgAに属する 抗原粒子が光学顕微鏡で充分観察できる大きさのものではないと凝集反応起こらない 凝集素価: 凝集反応を示す最高希釈倍数 2) 沈殿 precipitation3) [Ag + Ab]-bind complement → [opsonization: enhanced phagocytosis] → induced hemolysis = Ag 溶血機構[Ab(赤血球) + Ag(血清)] + C: これを用いてAb-Ag-reactionの強さが計れる
抗体保存: Ibを含まない血清にしておく |
オプソニン作用 (opsonization): 食細胞機能を促進すること – 生体防御機構としての重要性
C1, 4, 2, 3まで結合すると促集 cell adhesion
Ex. 1. ヒツジの白血球は5-6のAbしか食べられないが、それ以上のcell adhesionが見られる = opsonizationの利点
起源: 個体発生および系統発生 細胞性免疫 (cell-mediated immunity)細胞質免疫 – 遺伝的に違うものを拒絶する認識系
a. 自己: autogenic, or syngenic – 免疫反応の証拠 (∵ 細胞移植が抗リンパ性のものを与えると反応する) Immunity ↔ (体)液性免疫humoral immunity
組織適合性 histocompatibility Ab gene(s)haploidあり。1個の遺伝子を有する 対立遺伝子がcodominately expressedH-Ag H-gene(s): major H-gene (強い拒絶) + minor H-gene (弱い拒絶) Ex. 皮膚の拒絶反応
一次反応: < 10日 = majorの違い
Table 5.2. 脊椎動物の各綱における同種移植皮膚拒絶
Exp. Xenopus: 雌性発生(4-5代繰り返すとhomogenous) Cf. 脊椎動物では20代程度でhomogenous
動物
移植片生着日
数
飼育温度
Major histocompatibility complex, MHCH-2: mosue / HLA: humanBirds, mammals: strain毎に違う – 均衡系を使っている それ以下(-円口動物まで): 野生のものを使用しており変異大 ⇒ かなりランダムな進化? 脊椎動物: allograft rejection / 無脊椎動物: in case, reject → メモリーがあるかどうかは未詳 Exp. キクイタボヤ(群体ホヤ) Botryllus sp. – 原索動物
異なったコロニー同士 &rar; "non-fusion" reactionがしばしば起こる - cytolysis
針を刺す(機械的な刺激だけで反応)。生理的食塩水を注入しても起こる Abの多様化機構 mechanism of Ab diversity1) 指令説instructive hypothesis vs 選択説 selective hypothesis (Poling 1950'): 抗原はプラズマ細胞に入って鋳型となり、それに対する抗体を作る。どのプラズマ細胞も全抗体を作ることができる
抗体産生細胞 → 抗体のもととなるタンパク質 → Agを鋳型に厳密な立体構造を抗体産生細胞中でとる
ダーウィニズムの焼き直し: 抗体の対応性というものはランダムにできる。多種多様な抗体産生細胞のクローンが存在する。抗原が体内に入って来ると、それに見合う抗原を作る抗体産生細胞のクローンが増殖する
C-regionに関しては極端に言えば1 geneでよい – 思ったより少ない遺伝子で多様性は形成される Ig-mRNA → cDNA → Ig genes = 構造決定
a) V1-Vn: 1遺伝子に1-n = ゲノム(n)あたり1個 [Cc, CH1, CH2, CH3] 遺伝子構造の変化
c) fetus vs adult
分化したlymphocytesでも他器官に分化する能力を有している。しかし、抗体を産生するかどうかは不明。抗体産生の遺伝子については変化が起きているのかもしれない Exp. Burnett (1950'): V-reigon diversity
個体発生中に起こるか、germ line (103 × 2)で規定されている – どちらが正しいとも言えない
Ag ← lymphocite (non-specificな副産物であるタンパク質) = direct Ib
a) A ↔ B: 相乗効果で増殖速度増す 細胞性免疫の存在1. 無脊椎動物: "包囲化encapsulation" – 昆虫で顕著リンパ球ではないか – 血液細胞 hemocytes (ホヤにはない) 2. 全脊椎動物 |
Cells and tissues commited to Ab responses1) Agの入る部位近くのリンパ節lymph nodes、膵臓spleenに最終的には行き、細胞内皮系reticuloendothelial system (RES) (mesoderm origin)に至る。抗体を作る細胞にAbは入って行かない – 指令説を否定する根拠の1つ 2) Ab形成部位: spleen, lymph nodesの"plasma cell" - Ab作る時期に増加Exp. プラズマ細胞がAbを作る証拠
→ Rat Ab – mouse Ig: プラズマ細胞中のRER内部でAbは作られる 一次(1°) lymphoid organ→ これなしにAbが分化する可能性はない1° lymphoid organ: 胸腺 thynus, ファブリシウス嚢bursa of Fabricius (イタリア解剖学者) 2° lymphoid organ: spleen, lymph nodes[発見の過程] 1) 胸腺切除 (Miller 1961): 成体adultで影響ない vs 新生児だと傷害発する Exp. New-born mouse thynus – 切除
a → T × → wasting desease and death (完全に雑菌を断った所で生育させれば生き延びる) 網目状の上皮性細胞がmedullaからcortexへ大量に出る
若い個体ではcortexのリンパ球発達。成熟個体では退化し、リンパの代わりに脂肪等が入りこむ 円口類: 未詳 魚類以上: 胸腺の存在は間違いなくseedingを行なっている 少なくとも、細胞性免疫を得る能力を初期に与えるのは胸腺の役目 2) ファブリキウス嚢 bursa of Fabricius (Glick 1956) Exp. Hatched chick bursectomy 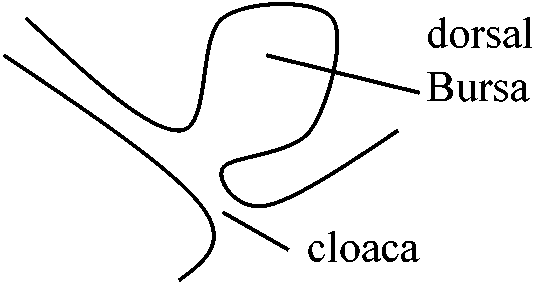
滑液嚢(包) bursa: 鳥類のみ存在 - 機能から考えれば他の動物に相同器官があるはず* Thynus × → celluar responese × Bursa × → humoral responese × 他の脊椎動物でもbasal-equivalent organの存在が推測できる |
3) Thynus and bursa lymphocytes (subpoulation): 個体発生段階で、この異常が起こる症候群が見られる Ex. ヌードマウスnude mouse
T cell ×: これをマーカーにして研究する試み
↓ skin graft rejection (3n), Ab produciton (2n) – helperの存在 [1983年: 多くが研究段階] Development of lymphoid cells and organs1° organ: endodermal epithelium魚以上の胸腺は全て鰓域branchial region Exp. Xenopus: host 2n
Thynus (2n) / transplanted graft (3n) 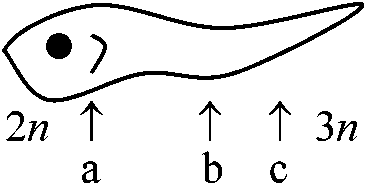
Stem cellsはanalagenに入っていける → lymphocytes (T/B) → periferalization (T/B) = Ag 胸腺で行なわれる
ATX cut ATX cut ATX cut
↓ ↓←AT ↓←BT (この実験はまず失敗する)
×graft rejection OK
A → O A → O
B → O B → ×
C → O C → × BTがAを認識しAに対して
反応し衰弱死に至る
Aは自分のことをまず認識可能となる。更にBへの認識能力を持つ (A&B-self) – 寛容"tolerant"
自己に対するクローン(random mutation)もできるが、発生初期に多量の抗原により抗体は消失する |
[ 解剖学 ]
形態発生(形態生成、形態形成 morphogenesis)生物の発生で新たな形態が生じてくる過程一般に、高次構造を持つタンパク質や細胞構成要素以上の単位における形態変化 → 高次複合過程 植物形態形成: 細胞間連結 - 植物では器官の分離なく常に細胞が連結1. 植物成長 growth/development Ex. 栄養成長・生殖成長・老化
循環過程 cyclic process
Ex. 休眠 dormancy、老化 senescence、加齢 aging 特別な代謝過程ありdehiscenceである 2. 分化 differentiation: Ex. 種子発芽 seed germination
分化成長 differential growth: 細胞間や細胞群間に何らかの相違が生じる事 (∵ 細胞間に相違が生じることが分化開始の徴候)
離生間隙 schizogenous IS: 細胞と細胞が離れ形成
器官決定遺伝子 organ identity gene 外部環境変化は、植物ホルモン生成・移動・不活性化を介し成長調節 → 植物ホルモン: 遺伝子プログラム発現や外部環境が遺伝子情報発現に影響を及ぼす時に、作動子としての役割 Ex. 古典的実験: 異常状態 → 植物反応 → 内部変化推定 
傷害応答 wound response 根形成は根端細胞分裂増殖活動による 軸状体制 (Fuller & Tippo 1949)
young: shoot apical meristem (根でも同様) Ex. 上に向かい茎を伸ばし、下に向かい根を伸ばす ☛ シュート 分裂組織 meristem (meristematic tissue) - 動物にはない
胚的発生embryonic development: 全細胞が分裂 → 胚完成 |
Plants: 無限成長 indeterminanistic growth = 分裂し生きている限り成長 Animals: 有限成長deterministic growth = あるサイズになると成長停止
↓ 植物と動物の成長の意味が異なる 植物の運動 plant movement成長運動 growth movement屈性 tropism: 刺激に対して体の一部を近づける(正)か遠ざける(負)
屈地性 geotropism = 重力
好光性 photophilic/photophilous
屈水性 hydrotropism = 水 雲母板: 子葉鞘に挟むとオーキシン移動しない ↔ やや下に挟むと移動 1959 柴岡・八巻: ヒマワリ若葉 - 光の当たる方のはでオーキシン生産傾性(運動) nastic movement: 刺激方向に関係なく刺激に対し一定の反応
傾光性 photonasty = 光 Ex. タンポポ・マツバボタン花開閉(明るいと開く) 膨圧運動 turgor movement傾触性(接触傾性, 振動傾性): 触ると急速に葉を閉じる運動 = 接触・振動生体膜電位が関与 Ex. オジギソウ葉 = 傾触性 + 就眠運動
葉柄基部の膨らみ - この中の膨圧により葉が支えられている (睡眠運動・昼夜運動)葉・花等が、昼夜の周期的明暗により開閉等の運動反応を示すこと傾光性 = 光・温度等 Ex. 葉: マメ科(オジギソウ、ダイズ、シロツメクサ、ネムノキ)、カタバミ 乾湿運動含水率変化に伴う運動
Ex. ホウセンカ、カタバミ果皮裂開。シダ胞子嚢裂開、マメ類鞘裂開 細胞内運動Ex. 原形質流動 |
|
Def. 植物ホルモン phytohormone (Larsen 1951)
高等植物生体内で作られる有機化合物で成長や種々の生理作用を制御する機能を持つ。微量で有効 Def. 成長物質 growth substance (≈ 成長調節物質 growth regulator)
低濃度で成長促進あるいは阻害する有機化合物。成長を質的に変化させるものも含む いずれの濃度でも促進作用示さない成長阻害物質 植物ホルモン ≠ 動物ホルモン
生産個所と作用個所が異なる必要はない 生物検定法 bioassay (測定法)生理活性物質検索に生物反応使い定量化 - 未知ホルモン検出に必須Ex. イネ葉身基部屈曲試験法 rice lamina joint test → ブラシノステロイド発見 - 類縁化合物発見につながる 感度高いが精度低い 精製 + 定量(ガスクロマトグラフィ, 高速液体クロマトグラフィ, 蛍光分析)免疫学的測定法/検定 (イムノアッセイ immunoassay)
酵素イムノアッセイ ELISA: 酵素結合抗体使用 - キット市販 a) オーキシン(成長素) auxinインドール酢酸 (IAA)、ナフタレン酢酸、インドール酪酸等の総称伸長成長変化や、セルラーゼ、β-1,3-グルカナーゼ、1-アミノシクロプロパン-1-カルボン酸(ACC)合成酵素等の酵素活性増加が、核酸合成阻害剤やタンパク質合成阻害剤により抑制 オーキシン作用発現には核酸・タンパク質関与 天然オーキシンIAA (+ インドール化合物) 1982 Cohen: ダイズ → インドールアセチルアスパラギン酸検出 1985 Sonner & Purvus: キュウリ → インドールアセチルアスパラギン酸 + インドールアセチルグルタミンサン検出 オーキシン賦活物質: オーキシンと共存するとオーキシン活性を高める物質
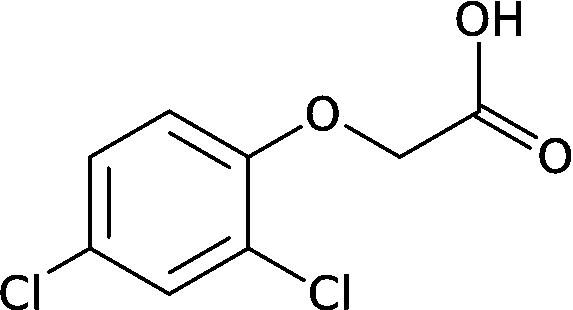
それ自身にオーキシン作用はない = オリーブ油がオーキシン賦活作用を持つ (人工)合成オーキシン2,4-ジクロロフェノキシ酢酸 2,4-dichlorophenoxy acetic acid (2,4-D, 2,4PA) α-ナフタレン IAA (C10H9O2) 2·4·5-T、M·C·P等 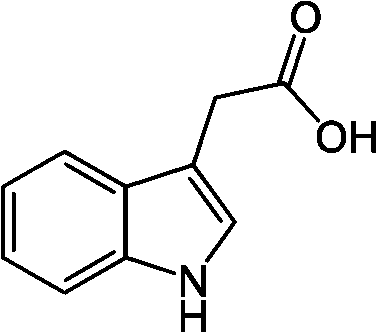
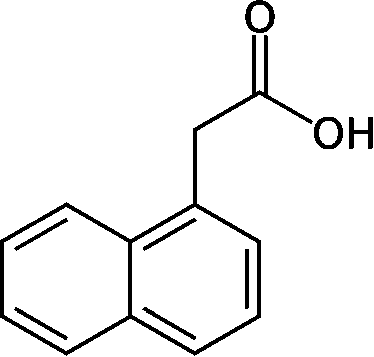 __________β-IAA__________2, 4-D__1-ナフタレン酢酸 (ルートン, NAA) 1926-28 Went FW: Avena子葉鞘 ⇒ アベナテスト確立 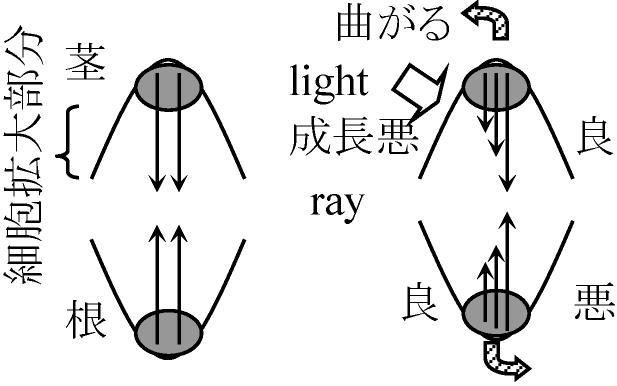
成長ホルモン [成長点 → 寒天 → 成長部]移動可能物質(液体) 屈曲量から未知ホルモン量推定可
一般に 低濃度 = 促進作用 ↔ 高濃度 = 阻害効果 阻害作用はauxinに誘導されるエチレン生成による効果 1950 Nitsch: イチゴ種子 - オーキシン生産 - 果実成長促進 1951 Addicott & Lynch: Coleus + オーキシン 離層葉側 → 離層形成抑制 ⇔ 茎側 → 促進 離層形成層両側オーキシン量比: 葉側大 → 抑制 (逆も真) ※ 後に離層形成にアブシジン酸、アミノ酸当も関与が知られる 1955 Jacobs WP: Coleus 落葉 - オーキシンが支配1964 Abeles & Rubinstein: IAA/NAAがソラマメ上胚軸のエチレン生成促進 1967 Chadwick & Burg: IAAがエンドウ幼植物のエチレン生成促進 仮説: × オーキシンの直接作用 ⇒ オーキシン → エチレン → 作用 1971 Vendrell & McGlasson: エチレン生成の自己阻害発見バナナ果肉切片エチレン生成 - エチレンにより阻害 極性移動Ex. IAA入り寒天 (材料示されていない)
茎先端切口上部に寒天 → IAA移動 ⇔ 茎下部切口に寒天 × 移動 生理作用細胞成長 Ex. 細胞伸長 ☛ 屈性高濃度で細胞成長抑制 (☛ 除草剤) 1969 Evans & Ray: 分単位で成長測定できる装置開発オーキシン処理 → 13分 → 成長開始 拡散合成・タンパク質合成阻害剤加えても13分 + 成長促進率低下 オーキシンに対する反応は阻害剤では影響されない 1971 Hager et al.: プロトンポンプ説 = オーキシン-酸成長説
オーキシンによりプロトン産出 - 低pHが維持される 維管束分化 Ex. 高濃度IAA → カルス分化 (↔ IAAなしで多くは増殖不可) クラウンゴール crown gall: IAAなしで細胞分裂進行 花芽形成 Ex. 中日植物(パイナップル、サツマイモ)の花芽形成促進頂芽優先(側芽抑制) Ex. 頂芽切口にIAA - 側芽伸長抑制 落葉・枯死 Ex. IAAを葉側に処理 → 落葉阻害 (茎側に処理すると促進)
→ 離層形成抑制 根原基成長に作用 (☛ 農業に応用) その他: 光周期性、発芽阻害、花粉管成長促進、原形質流動促進等生合成IAA生合成: トリプトファン(Trp)が出発物質(根拠) Trp多い組織でIAA多い + TrpからIAA生成酵素豊富 1987 Law: 経路(の一つ): Trp (出発点) I: インドール
→ (トランスアミナーゼ) → Iピルビン酸 → Iアセトアルデヒド → IAA 破壊: 酸化による (不明点多) b) ジベレリン gibberellin, GA1926 黒沢英一: GA発見(後に一般の植物に存在するホルモンと判明)イネ馬鹿苗病は馬鹿苗菌が寄生し、その分泌により生じる 1938 藪田・住木: GA結晶化 - gibberellinと命名
丈低い植物に著しい成長誘導 → 丈低 = GA生産相対的に少ない個体 1959 Cross et al.: 平面構造決定 1959 河原田・住木: ミカン徒長若枝からGA1確認 (GA ⊂ 植物ホルモン) 同年にベニバナインゲン(英)、トウモロコシ(米)からGA1確認 1966 McCapra et al.: 立体構造決定生物検定法 bioassayGA塗布 → 成育促進 (対象種、使用GA種により応答異なる)Ex. (矮性)イネ点滴法 (村上 1968)、浸漬法 Def. GA: 化学構造による• エント-ジベレラン骨格からなり20個の炭素を持つ • GA12-アルデヒドの20位の炭素が離脱した(19になる)ジテルペン有機酸 GAn or An: 構造が明らかとなった順に番号(2020年 n = 136) 生理活性は異なる Ex. n = 1, 3, 7, 30, 32 ⇒ 高生理活性高傾向: 3位(A環)と13位(C環)にOH ↔ 低傾向: 炭素20個のGA 他物質と結合し存在 Ex. 未熟種子中の GA3グリコシド作用: 移動に極性がない等の点でIAAと異なる
作用機構 膜系に働く (種子休眠にも膜系が関与) 成長抑制物質による実験
1941 Mitchel: 2, 4-dichlorobenzylnicotium chloride(合成化合物) 報告: 実際の植物体での生理効果は1 nM以下で機能 |
生合成 (☛ biosynthesis)殆どの組織で合成 - 根、芽、種子が主ミクロソーム中の水酸化酵素が働く c) サイトカイニン cytokinin, CK1955 Miller & Skoog: アデニンに強い細胞分裂促進作用DNA加水分解物を組織培養培地に付加 → 増殖促進 カイネチン ≡ DNA加水分解物を精製・結晶化した物質 サイトカイニン ≡ カイネチン同様の生理作用持つ天然化合物総称 (s.s.) Def. s.s. + 6-aminopurineの6部位アミノ基に通常炭素数5の置換基が結合した基本骨格持つ誘導体群(9位のN原子にribofuranosyl基かribofranocylphosphate基が結合した形でも存在) 1963 Letham: トウモロコシ未熟種子ゼアチンzeatin抽出: カイネチン様生理作用 ⊂ 植物ホルモン 合成CK: ベンジルアデニン benzyl adenine (BAP)生理作用 細胞分裂促進: 植物培養細胞 - オーキシンとの共同作用
カイネチン濃度の影響は組織で異なり、低濃度で根分化、中濃度で著しい細胞質分裂とカルス塊形成が起り、高濃度で葉条芽の分化がみられる + (サイトカイニン/オーキシン) ⇒ 細胞分裂開始 1980 Huneeus: ゼアチン、イソペンテニルアミノプリン 繊維芽細胞(良性腫瘍)DNA合成促進 1981 Becker & Roussaux: ショウジョウバエ培養細胞増殖促進 側芽形成促進 ⇒ 木部分化促進老化抑止 (⇔ ABA: 老化促進 1957 Richmond & Lang: オナモミ葉柄をCK水溶液に浸漬 長期間緑色を保つ - 低温ほど顕著 気孔開閉: CK処理植物 - 暗所にしても気孔閉じないタバコ葉: 処理2分後に気孔開く - ホルモンとしては極めて早い反応 酵素活性増加 Ex. 硝酸還元酵素生合成CK: 根・種子に多い - 関連組織で合成される?d) アブシジン酸 abscisic acid, ABA1949 Hemberg: ジャガイモ塊茎表皮近く - 発芽阻害物質局在 (後のABA)1953 Bennet-Clark Kefford: 阻害物質を阻害物β (inhibitorβ)と命名 1957 van Stevenick: キバナノノボリフジ落下促進物質の存在を報告 1961 Liu & Carns: ワタ葉柄由来の落葉促進物質 アブシジン abscisin (abscissionから)と命名 1963 Addicott et al.: ワタ未熟果実から同様の物質単離 - abscisin IIと命名1965 大熊和彦ら: abscisin IIの構造決定 1965 Cornforth JW, et al.: カエデ葉から冬芽休眠誘導物質単離 ドルミン dormin (dormancyから)と命名 構造解析: 3種は同一物質 ⇒ アブシジン酸abscisic acidに統一
休眠や成長抑制、気孔の閉鎖等を誘導 生理作用成長抑制物質 - 休眠芽形成高濃度ABA/低濃度GA → 休眠誘導 低濃度ABA/高濃度GA → 休眠解除
Ex. キク、クロスグリ、タマネギ、ウキクサ、ワケギ キュウリ胚軸等からは成長促進作用が報告される 発芽抑制: (一般に)ABA濃度は、種子 < 果実 ⇒ 果実中ABAが発芽抑制∵ 果肉を洗浄すると種子が発芽する 水ストレス: 実生萎凋 → 阻害物β↑ - 阻害物主成分はABA (1969 Wright)気孔閉孔: 乾燥 → 葉でABA↑(根、茎、果実での変化小)
ABA処理 → 気孔閉孔は数分で開始 果実成熟・落果: 若果実 + ABA処理 → 落果促進 Ex. モモ、リンゴ、オリーブ、ミカン e) エチレン ethylene, C2H4, CH2=CH2= 落葉現象・休眠打破・他感作用等に関与C2H4増加による落葉は核酸合成阻害剤やタンパク質合成阻害剤で抑制 → 核酸・タンパク質合成関与 グレープフルーツ外果皮切片でPAL誘導可溶で脂質にもよく溶ける 炭化水素hydrocarbonに特異性がある C2H4はDNA合成開始寸前に与えた時、DNA合成最抑制 G1-S期へ移行上ではS期直前のタンパク質合成直前の所に位置する CO2との関係 Ex. 果実成熟: CO2により抑制 vs エチレンにより促進
互いに拮抗的阻害 ☛ 拮抗作用 水生植物の特徴? エチレン代謝の生理的機能組織内エチレン量調節: 受動的エチレン排出(拡散) + 能動的エチレン排出エチレン作用にエチレン結合部位酸化に必要 - 否定的 エチレン酸化により植物組織感受性変化: Ex. 酸化エチレン↑ → 組織感受性↑ 生体制御(生理作用)休眠打破(発芽): 内生エチレンによる (1926 Haber: 外生エチレンで発見)Ex. オナモミ種子: エチレン生合成抑制 → 休眠 (他にオオツメクサ等)
⇔ Potentilla norvegica: エチレンで発芽阻害
スパニッシュ種: 発芽過程でエチレン発生 → 発芽 空気 12% ⇒ 空気 - (C2H4 + CO2) 0% ⇒ + C2H4 62% ⇒ + CO2 83% 高い発芽率の環境は土壌中に似る 伸長成長 (上偏成長: 葉柄上部が特に成長 - 下垂する)1970 Suge (菅洋): Oryza + エチレン → 子葉鞘伸長促進 水生植物 ↔ イネ科牧草種では阻害 植物運動屈地性 geotropism・屈曲性(根) (Chadwick & Burg 1967) 分化 differentiation 開花阻害 Ex. アサガオ - 長日で花芽形成 - エチレンで阻害 花芽形成 Ex. パイナップル: オーキシン → エチレン生成促進 → 花芽形成 雌雄決定 Ex. キュウリ: 高濃度処理で雌花化 (機作は花芽形成と同) 老化 senescence: エチレンで加速 = 関連酵素↑ 1967 Matile P, et al. (+他研究): Ipomoea purpurea 開花 → 落果(老化過程) 老化中 = RNase↑, DNase↑: 酵素は液胞中 - 構造物を取り込み分解 離層形成 abscission layer formation ☛ 落葉、落果果実成熟促進 (オーキシンとの相互作用 クリマクリテック・ライズ climacteric rise: 呼吸 = 成熟時急激増加 → 低下
= エチレン濃度が通常の1000倍以上に増加している
パイナップル: タンパク質分解酵素、インベルターゼ増加
非クリマクリテック果実 Ex. ミカン、ブドウ、イチジク、スイカ 土壌中エチレン ethylene in soil酸素エチレンサイクル ethylene oxygen cycle
トマト: 土壌中 = 浸水 + 嫌気的 → エチレン生産 - 成育異常
Ex. オオムギ: 種子根主軸部短縮 f) ブラシノステロイド brassinosteroid, BRs1950s-1970s Mitchell group: アブラナ花粉中物質
→ インゲンマメ第2節間成長促進
= ステロイド化合物(骨格) + ラクトン環 g) フロリゲン (開花ホルモン, 花成ホルモン) florigen1937 Chailakhyan: 花芽形成で日長を感知するのは葉(謎の)花芽形性物質( = フロリゲンと命名): 葉 → 茎頂 2005 Tamaki (玉置) et al. シロイヌナズナ
日照条件が変わると維管束細胞でFT遺伝子発現 → FTタンパク質合成 = Hd3aタンパク質 植物生育調節剤 plant growth regulator, PGR成長発育をコントロール - 農業: 品質高める、収量安定増加、省労力植物ホルモンとその類似有機化合物(生理活性物質)が主 Ex. エテホン(成分名, エスレル = 商品名): 分解しエチレン生成 開花促進、着色・熟期促進、離層形成促進、倒伏軽減等 遺伝子発現のホルモン制御オーキシンにより誘引されるRNA代謝の変化オーキシンによりDNA polymerase活性化され、ポリメラーゼ合成に関与するものの何かを活性化している同様のことがCK, GAでも発見される |
分裂時期 phase体細胞分裂 (somatic division)G1: DNA合成準備期 → S: DNA合成期 → G2: 細胞分裂準備期→ M: 分裂期 [前期、中期I/ II、後期、終期] → G1 … 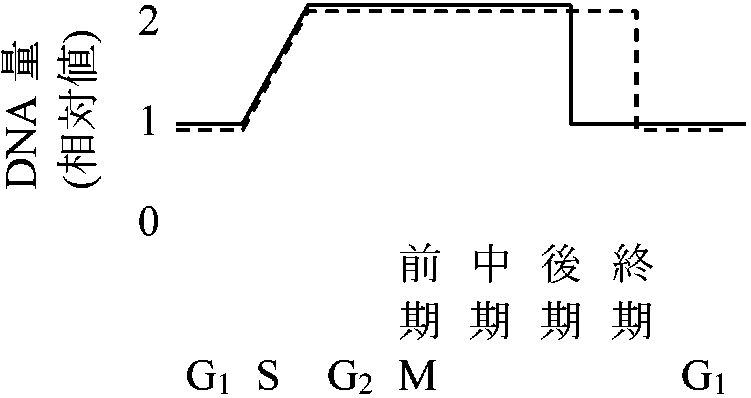 前期: 染色体短縮 - 縦裂 - 染色体分体
前期: 染色体短縮 - 縦裂 - 染色体分体中期: 核板 - 紡錘体(紡錘糸) - 動原体 後期: 娘染色体 - 極に向かい移動 → 紡錘糸(染色体糸) --------- 後期: 1染色体あたりDNA量(動原体が2つになり半分になる) 終期: 赤道面に隔膜形成 + 細胞壁発達 - - - - - 終期: 1細胞あたりDNA量(細胞質分裂により半分になる) ☛ 植物細胞分裂観察 減数分裂 (meiotic or reduction division)分裂期2度第一減数分裂(M1)期 + 前期 prophase、中期 metaphase、後期、終期 telophase 第二減数分裂(M2)期前期、中期、後期、終期 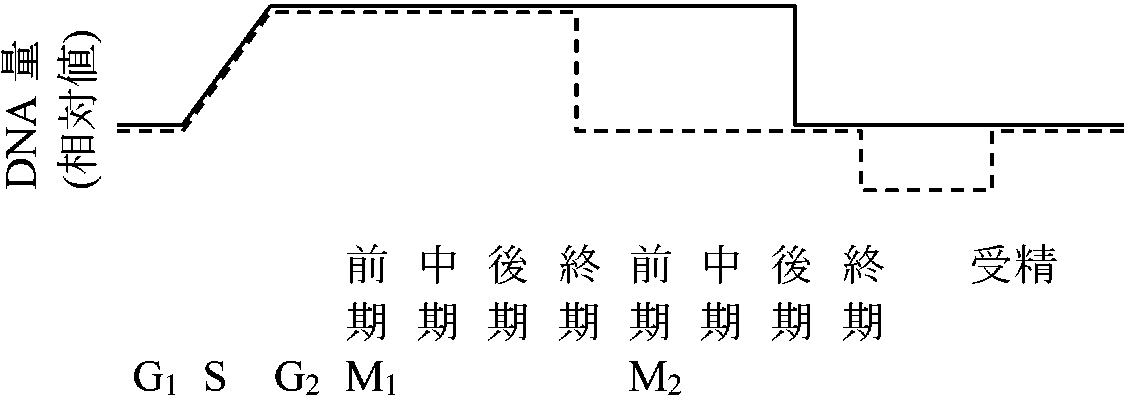 DNA合成: DNA収縮、染色体分離 植物ではDNA量は2cのほかに4c, 6c, 8c等がある どのような過程でG2からMへ移行するのか 細胞周期誘発 カルス形成(auxinによる誘発が一般的、CKはこれを補助することがある) → 脱分化 → 再分化 不等分裂unequal division= 細胞機能分化の形態上の第一段階 → 不等分裂によって機能が決定される
根毛root hairや気孔stomaでよく観察される
▆ → ▆ ▆________▆ → ▆ ▆▆
二叉分枝: 分枝後に不等分裂見られる 1949 Cormack: trichoblastから発生した根毛はある染色液でよく染色される 1959, 1964 Avers et al.
Cormack (1949)の原因はcytochrome oxidaseの差と関係
被子植物: 雄蕊葯中で花粉母細胞から減数分裂により花粉形成
不等分裂 = 極性あり紡錘体も一方鋭端、他方鈍端となり易く鋭端側に花粉管核、鈍端側に生殖核を生じる
二極性花粉: 花粉粒中で生殖細胞が1個で留まり花粉管移行後に分裂 
Condensed nuclei: 重複受精のためのDNA合成(回りに細胞壁を有するので細胞と呼んでもよい) |
1942 Swanson
細胞壁または液胞との位置関係が問題 単粒 monad: 花粉が1粒1粒単独となるもの 複粒 composite grain: 複数の花粉が分離せず散布される
二集粒 dyad: 2粒の花粉が集まった複粒 1953 Bünning & Biegert
 1948 Bünning & Sagromsky
1948 Bünning & Sagromsky
不等分裂を抑制(あるいは促進)する物質分泌 → 一定間隔に気孔形成
*: 不等分裂: 小さい方の細胞が助細胞 subsidiary cell になる
大きい方の細胞の核だけがラベルされる (× 小さい方) 分裂軸の決定1863 Hofmeister: 長軸垂直説
_______▆_____→___▆▆___→_____▆ ▆ 周囲からの圧の方向によって分裂軸が決まる 1958 堀田・大沢: タンパク質種説羊歯: m-RNA region – タンパク質の種類によって規制される ⇒ 上記3仮説は全て否定された1966 Pickett-Heaps & Northote
cellulose in cell wall → structure of microtubles (random structureの場合もある)
= 等分裂、不等分裂を起こす位置、即ち細胞板cell plateのできる位置がpre-prophase bandの位置と一致
ムギでみられたような現象は観察されない ただしcell plateはpre-prophase bandの位置にできる ⇒ Pre-prophase bandは分裂面を決める要素ではないという見解もある
核分裂に際しての核の移動
|
日、季節、年等の単位で経時的変化する生物リズムを研究 Ex. 種子発芽
サーカディアンリズム(概日リズム) circadian rhythm内生的なendogenousもので殆どの生物に存在1729 de Mairan (仏): 内在的概日リズム報告 就眠運動: オジギソウ葉は、外界刺激がない状態でも約24時間周期のパターンで動き続ける circadian = circa (約、概ね, L) + dies (日, L) = 概ね一日(s.s.) 内在的にのみ形成される概日リズム (s.l.) 光温度等、外界刺激により修正されるものを含む
周期活動 rhythmic activity or periodic activity外発的(外在的) exogenous vs 内発的endogenous日周期 diurnal rhythm (daily or diurnal rhythmic activity): a cycle based upon a daily periodicity
昼間活動型 diurnal type
潮間周期活動 tidal rhythmic activity 早春前線 = 日平均気温摂氏5°Cの北上ライ (エゾユズリハ・ツルシキミ開葉は対応) 光形態形成 photomorphogenesis(低エネルギーの)光による形態形成制御 Ex. 光周性1924 Marcovitschi S: アリマキの1種の繁殖 - 日長依存 1924 Rowan W: Junco hymalis (ヒワの1種) - 渡り周期が日長依存 生殖ホルモン分泌 菌類における光形態形成1938 Christenberg GA: Choanephora cucurbitarum (ケカビ病菌) 胞子形成 - 光照射で誘導 ↔ 連続光では形成されない ⇒ 暗期必要 1950 Barnett HL & Lilly VG: C. cucurbitarum (━ 強光 ▇▇ 暗黒 ▇▇ 弱光)
胞子形成(+/-) ⇒ 2反応系 (1) 光必要, (2) 暗黒-弱光下で進行(光に阻害される) 光周性 photoperiodicity or photoperiodism日長 day length (日照時間)変化に対する生物反応の変化
Ex. 植物花芽形成・開花・結実、鳥類等生殖活動 ニセアカシア: 短日条件下より長日条件下で育つと強耐寒性 1920 Garner WW & Allard HA: 光周性(日長反応性)発見 - タバコ
突然変異(cv. Maryland Mammoth)は普通種より遅れ12月中旬頃開花
師管 日照時間変化: フロリゲン分泌開始 → 水溶性ホルモン 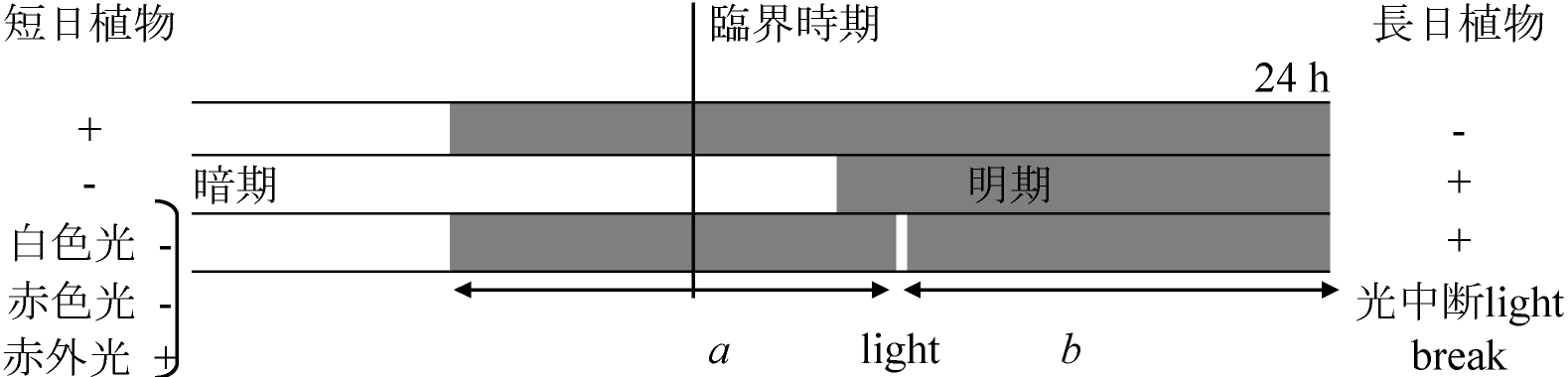
a + b > 臨界時期 – 暗期中頃に効果大(暗期直後、明期直前効果小) 休眠 - 成長調節物質成長促進物質欠如 → 休眠 and/or 成長抑制物質蓄積 → 休眠 |
光受容体1. ファイトクローム phytochrome: 赤・遠赤, 植物特有
植物、真菌、細菌、藍藻に含まれる色素タンパク質
PHY A欠失 – 開花時期遅れる、葉数増加
PR ⬅ P650 定常状態は見かけ ※ 反応: 伝達 vs 局在表. 短日植物と長日植物
Ex. メダカ、フナ、アマガエル 2. クリプトクロム cryptochrome: 青色光受容体1993 Ahamad et al.発見
構造: 光回復酵素と相同性 - 動物にもクリプトクロム存在示された
cry1: 脱黄化や明所での形態形成に関与 黄化 etiolation: 暗所成育 → 葉黄色 (+ 間延び) Ex. もやし
被子植物のみ(裸子植物ではみられない) 青, 植物特有 = 光により活性化されるタンパク・キナーゼ 1997 Liscum et al.発見: monomer m.w. ≈ 10万 → 色素タンパク質N末端側にFMN結合するLOVドメイン2つ、C末端側にセリン/トレオニン・キナーゼドメインもつ LOVドメイン: PASドメインの1種 (バクテリアにも見られる)
LOVドメイン: FMNを結合し、光で励起されると、FMNとアポタンパク間に共有結合形成 日周性Ex 1. ミジンコ生息地Ex 2. 気孔開閉 Ex 3. 昼行性動物: モンシロチョウ、ミツバチ、ハエ、ヘビ、トカゲ、スズメ Ex 4. 夜行性動物: スズメガ、イエカ、ヤモリ、コウモリ、ネズミ、フクロウ |
|
植物体内で細胞位置により分化決定 → 植物細胞 = 分化全能性 totipotency ☛ 維管束分化 発生に際し分化が起こる: 分化中にA → Bという不可逆的状態遷移起こる(これがまったく異質なものへの遷移かどうかが問題) ☛ 分裂組織 Ex. Bacillus subtilisVegetative cell ⇔ Spore: 細胞型分化? すなわち不可逆変化 – グルコース、ラクトース利用様式変化
Ex. 筋肉 肝臓 |
DNA → RNA → タンパク質 → 酵素 → 合成* *: 炭水化物、脂質、ホルモン 等 分化制御はどこでいつ行われるのか 再分化 redifferentiationカルス callus: 未分化な状態の細胞集団
脱分化: 未分化の状態に戻った細胞集団
脱分化: 師部phloem組織片 → ココナッツミルクによるサスペンションカルチャー → free cells |
重複受精 double fertilizationと分裂パターン1. 花粉・胚嚢形成
花粉母細胞(2n) → 減数分裂 → 花粉細胞(n) → 変形 → 花粉(n) = 4個 → 風媒花、虫媒花、鳥媒花、水媒花等 3. 受精 fertilization
精核(n) + 卵細胞(n) ⇒ 胚(2n)
柱頭: 糖類を含む粘液分泌 = 花粉発芽時の水分や栄養物質を与える ⇒ 重複受精: 形成された精核2個が、個々に卵細胞・極核と受精 もっとも多くの種が3核を有する = synchronized
動物で行う遠心等処理できれば細胞質の違いによる分化機構解明可 核内倍加 (endoreduplication)細胞分裂無に染色体複製がが起こる動物(ショウジョウバエ唾腺染色体等)で広く知られるが、植物でも報告例増 1965 Kato: Lillium = 染色体異常が植物の貯蔵器官では普通に見られる
Ex. Mutable gene → modification ホルモン勾配、培養、twin等を用い研究中(詳細未詳) 1966 Loyd & Prott
|
貯蔵タンパク質 storage proteins1895 Osborne
植物は数種の貯蔵タンパク質を適当に有するのが普通
受粉後15日まではpolysomeが多い = タンパク質合成が盛ん(他からm-RNAを与えようが関係なし)
Zein: membrane structure (memblant association)
Zein A (21600) (22500) タンパク質を単離しsolubilityを計る Fluorographyの手法
葉のpolysomeのpoly(A) + RNAを集める → single peptideのm-RNAを作る → complementary DNAを作る → Clone化 → milipore filter上で変性させくっつける → poly(A) + RNAを遠心分画 → 大きさによって分ける → それぞれの分画でfruorographyを見る → この様に確かめてsequenceを作る 1981 Goldberg et al.: ダイズの作られる過程 1981 Meinhe et al.
1981 Meinhe et al.
Glycine
Transcription levelで制御される Northern blot hybridization: RNAをgelで流す → cDNA: ラベルし混合 → radioautography |
胚 embryo: 水含むとGA合成↑ → α-アミラーゼ合成↑ → オーキシン → 分化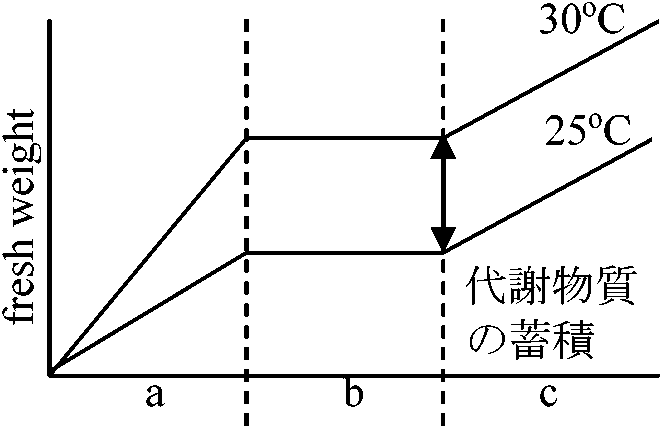
発芽3必須条件 = 水・温度・酸素1. 水 water: 過剰にあると酸素欠乏を起こす → 吸水能力と発芽の関係
吸水 imbibition
最高温度maximum temperature > Ex. ハルタデ・ブタクサ・エノコログサ: 0-4°C 土壌中暖かく休眠打破不可 → 表面露出で発芽条件揃う Ex. Polygonum cuspidatum: 風散布 → 重い種子 →
種子生産数少 → 休眠種子: という戦略的進化(推定) 4. 光 light 1952 Bothwick et al. ☛ ファイトクローム (phytochrome) 1959 Butler et al.: 光反応受容体発見 (後ファイトクロームphytochrome命名)
単量体 mw ≈ 125000 1994 Bewley & Black: 光要求性
光受容によりPfr増加 → m = Pfr/Ptotal > k (k: 種固有定数) → 発芽 Pfrが分解等により減少 → m低下 = さらに発芽しない 光要求性でない種子でも長期埋土により光要求性種子になる種がある 1990 Smith et al.: ギャップ種 = 緑陰感受性緑葉は赤色光吸収 → 森林地表面では赤色光少 → Pr↑ → 発芽しない 発生と呼吸Radicle = 呼吸系 ⇒ O2/CO2 = RQ: 子葉ではTとAが回らない – NADP少(ATPも少)
子葉 イソクエン酸 NADP+
↓ ↓ NADPH + H+
Cytric lyase ↓
↓ CO2 – H2O
オキザロ酢酸
デンプンがどのように使用され分解されるか
a: α-amylaseできない → GAを入れるとできる chromatin: RNA polymeraseを持つ → GA3により活性化された可能性 1970 Johnson & Parves: 12-24 hr, IAA
GA3 → 40-70%促進
+ GA3 → RNA (GA3によって合成促進) → poly(A) + RNA GAで促進: protase, end-β-glucanase, phosphatase, Rnase 1968 Beevers & Splittstoessor: Protease
麦wheat: 2次元電気泳動 – 100-200種のタンパク質を識別できる 1975 Spiegel et al.
mRNAとrRNAを同量作る → 発生進むにつれrRNA合成が盛んに成る
active chromatin, inactive chromatin
H1がなければconformationが変わる
|
1977 Yoshida & Sasaki
コムギ胚のchromatinをとりin vitroでRNA合成を行う
+ 2, 4-Dでニンジン細胞を増殖させる → ある時点で-2, 4-Dに移す → 分化を始め胚発生が開始される 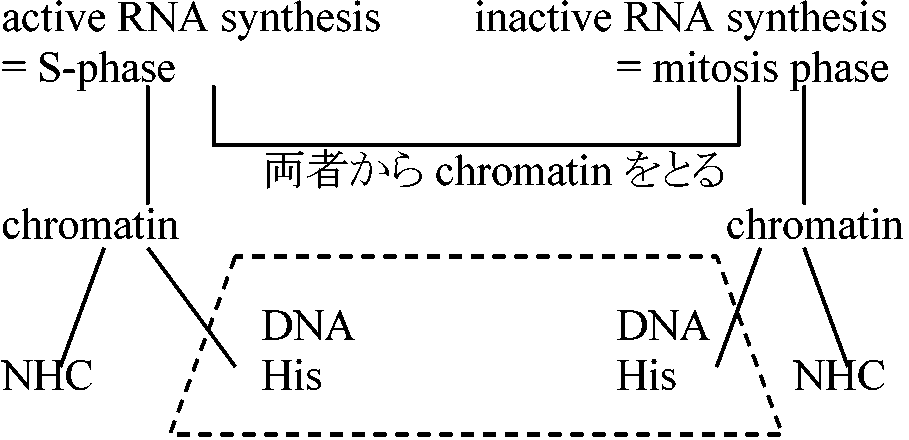 再構築させる時にS-phaseのNHCを入れればS-shapeのchromatinに似て、mitosis phaseのhistoneのNHCを入れればmitosisのchromatinに似る。Histoneのm-RNAからhistone DNAを作り、これをS-shapeのRNAとhybridizationさせるとhybridizeするが、mitosisではできない 1978, 79 Lery, Comner & Dixon
HMG (high mobility groups NHC-protein): 転写に活性のあるchromatinで作っているらしい
mouse神経芽細胞neuro blastoma cell 白血病細菌Erythro bacteria cellに20% Me2SO4処理 → globulin mRNA synthesis → (HMG 1, 2) → chromatinにassociateした / 25000 daltonのタンパク質増加 1976 Weintraub & Groudine赤血球細胞: globulin geneはDNAseでダメになる。fibroblastではglobulin geneはDNAseで処理しても保存される。HMGがなくなるとDNAseに対する感受性が高くなる 1981 Keene et al.
ショウジョウバエDrosophilaのheat shock protein (hsp)
Super coilがほどけたとき1つの環は14個分位のnucleosomeが入る大きさである 植物におけるtranslationの制御mRNA: active or inactivetRNA rRNA tRNA: aminoacyl-t-RNA合成 individual amino acids: degenerasy → isoaccepting t-RNA: 分子種 14C(3H)-leucine, tRNA 1-6 ※ 同一種でもどの組織でどの遺伝子を用いるか = 使い分け 細菌: 良く使われるcodeの遺伝子は良く保存されている 1970 Vanderhock & KeyPea root: elongated part (伸長部)とmeristemのtyrosine tRNAを比較 ⇒ 分裂の有無とあまり因果関係なし 1972 Merrick & DureCotton – leucyl-t-RNA, negative ⇒ Chloroplastは発芽に際して変化 1970 Reger et al.: Iso-leucine
*: 突然変異を起こしている場合がある。ribosomeのタンパク質と結合する部位 1970 Isono & Witmann: E. coli突然変異株を二次元電気泳動で調べる
r-proteinの変異 → 機能が持てないribosomeができる(実際に区分ができないので未確認) 巣まき種子を幾分かためて播種 (ルイセンコ考案 – 原理説明は全く間違えている)→ 発芽が早くなったり、成長がよくなったりする |
[ 種子休眠 ]
|
Def. 生理要因または環境要因により生理活性低下し成育が停止した状態 休眠種子: 80S monosomes, active ribosome – 違い 1971 McCarthy: イネ, 28°C 非吸水種子リボゾームと吸水リボゾームを比較
Mg
Dry
Imbibed
タンパク質合成が始まるためにはまずリボゾームが吸水により解離せねばならない
小麦: ER-polysome bound – water stress: こふん層 – free polysome 1970's Rabinovitz group (in London)
Heme-controlled receptor Wheat germination cells: eIF-2 kinase |
1971 Ilan & Ilan
Tenebrio molitor: Pupil – ribosomes (60S + 40S), Larvae – ribosomes → in vitro translation 伸長因子 elongation factorrye, wheat – 古いものは発芽率低下: dry seed (水分はある) – 内部で代謝が起こっているとは考えにくい1973 Roberts & Osborne: stable m-RNA
発芽率低下 = 代謝(特にタンパク質)の低下 → stable mRNAがだめになった ⇒ Aminoacyl-t-RNA bindingに関係 1972 Tome et al. |
細胞分裂の方向 - 分裂面細胞分裂が様々な方向に起こる → 立体構造垂層分裂 anticlinal division: 細胞壁が表面に直角に形成される分裂 並層分裂 periclinal division: 細胞壁が表面に平行に形成される分裂 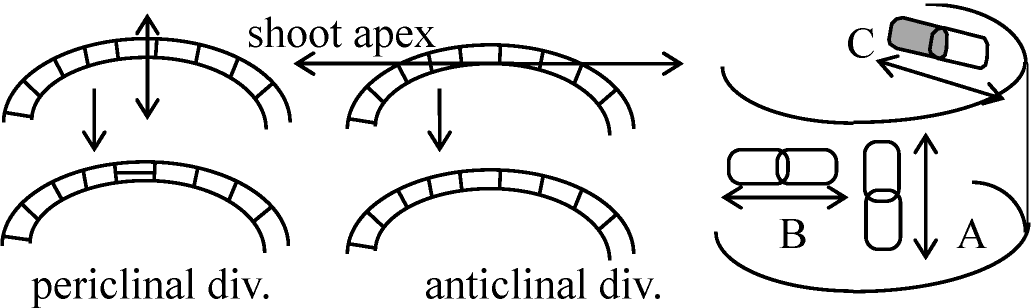 斜分裂 oblique division: 中間的斜め分裂
斜分裂 oblique division: 中間的斜め分裂茎・根における細胞分裂茎・根 = 一般に円柱状 ⇒A. 横分裂 transverse division: 植物体軸に直交する面に細胞壁形成
偽横分裂 pseudotransverse division: 横分裂と放射分裂の中間的な分裂 (⊂ 斜分裂) C. 接線分裂 tangential division: 円柱表面に平行な面に細胞壁形成 Ex. 形成層から師部・木部細胞が作られる時 
A, B分裂は表皮系epidermal systemのみ増える ⇔ Cの分裂では内部が増える 分裂要因 division factors
= liquid film theory - 分裂を石鹸膜のようなものと考える 1902 Kuzy: Least surface theory = 圧力方向に分裂面できる 1974 Lintilhac: 細胞にかかる圧力の方向から分裂面を計算
⇒ 要因: light, pressure, gravity, temperature 分裂組織細胞分裂形 = 近球形(平均14面) / 液胞 = 少内容: 密 - fast greenに染まる ⇔ 細胞壁: 薄 - safraninに染まる 細胞間位置関係の再調整形成層以外の細胞同調成長 symplastic growth: 隣り合った細胞も同時に発達 → 同調分裂 co-ordinate growth - 圧力(物性)関係
滑り成長 sliding growth: 細胞壁が滑り再配置され細胞が伸び植物が再成長 ⇒
☛ 茎頂 (shoot apex) キメラ chimera同一個体中に遺伝子型の異なる組織が接触し存在する現象Ex. ナス-トマト接木: 起源の異なる組織が混ざる植物体 Ex. 斑入葉(斑葉) variegated leaf: 斑入は、茎、花弁、種子等でも起こる
斑入部: 葉で白色等の緑以外の部分 孔辺細胞(表皮細胞と起源同じ)を光学顕微鏡観察 → 確認可
茎頂構造と関連したキメラ3型 茎頂切片観察では葉緑素を作る細胞かどうかは不明 → 細胞キメラ活用 細胞キメラ (cellular chimera)一個体の中に複数の倍数性持つ細胞が混在 → 表皮-表層分化がn数で分かる
Ex. 静止核状態細胞サイズ 2n < 4n (図5.11) 1940 Satina, Blakeslee & Avery: コルヒチン処理 = 細胞分裂中期で停止最初はDaturaの3層茎頂端で研究
茎頂にコルヒチン含む脱脂綿を載せた
2n, 4n, 8n(稀)形成 ⇒
最外層(並層分裂しない独立層) + 第2層(層をなす) + 内層(細胞が様々な方向に分裂)
ツルコケモモ、モモ、リンゴ等の茎頂: コルヒチン処理 →取り出し成長
(1) 節間短、葉厚・長・幅広・暗緑色、気孔大 = 全組織細胞4n 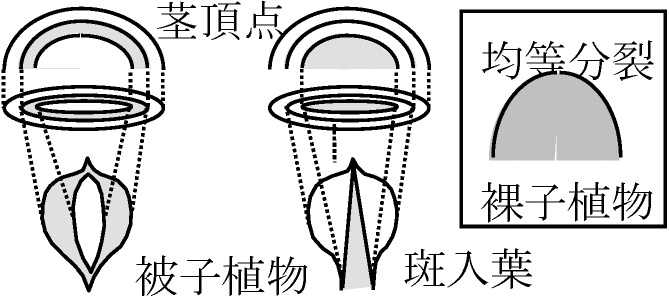 キメラがみられるのは被子植物のみで、裸子植物や羊歯植物ではない
キメラがみられるのは被子植物のみで、裸子植物や羊歯植物ではないキメラにはgene layerが必要 裸子植物ではキメラができない → 全部均等に分裂 葉の発生成長 leaf development and growth表面観察 = 顕微鏡観察 + 内部観察 = 切片作成観察(固定・染色)
↗ 前表皮 → 表皮 初期 = 3段階 ⇒ 発生 initiation: 頂端分裂組織部分に突起 →
羊歯: 頂端始原細胞 apical initial 分化
頂端成長 apical growth → 双子葉植物: 周縁始原細胞 marginal initials + 次周縁始原細胞 submarginal initials
周縁成長のタイプ
┏━━━
━━━━━━━
上側前表皮
→ 上側表皮 周縁分裂組織と葉組織由来の関係
⇒ 周期性 - 葉間期変化 plastochronic changes Ex. 葉の発生
最大期に層化stratification進みやすい = 外衣層数が増す 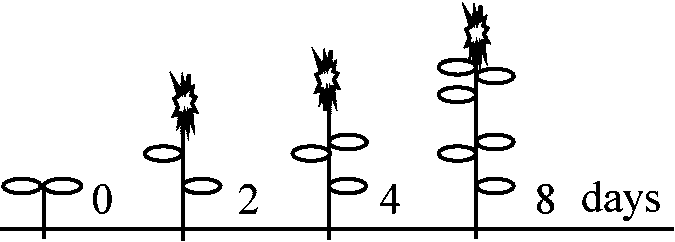 葉間期 = 2日 ⇒ 既にできた葉のサイズから茎頂芽発達は予測可能
葉間期 = 2日 ⇒ 既にできた葉のサイズから茎頂芽発達は予測可能
1966 Denne シロツメクサ: 2列互生葉序(葉原基は茎中心に左右2列に並ぶ)
葉原基連続切片作成可能 - 葉原基発生過程観察容易 葉間期 = 86 hr, この間に細胞数は2.5倍 ≈ 64 hrで細胞数は倍 1968,1970 Lyndon エンドウ: シロツメクサ同様茎頂観察に適葉間期 = 46 hr (前半 30 hr + 後半 16 hr) → 細胞数3倍
前半: 葉原基関係部分成長 ⇒ 後半: 茎頂そのものの成長 → 前半後半の違いは成長割合の変化ではなく成長方向の変化による 葉の配列を説明する2つの説: 2説は対立仮説ではない反発説: 葉原基間に互いに抑制(反発)し合う作用 ∝-1 距離 → 閾値下回る距離で新たな葉原基形成 (☛ 数理モデル) 空間説: 葉原基が茎頂周縁部に発生する際、先行する葉原基からの距離を最大化する位置選択 = 葉原基発生位置が茎頂形状・空間により制約 体構造・発生過程走査型電顕で観察容易茎頂点(面) ≠ 円 ⇒ a, b, cの様な部分から次の茎頂原基発生。面回転しつつ新たな葉を産んで行く様な動き
1967 Wardlow: ある植物では不定根のでる場所・数が決まっている
→ 形成層と関連 = 葉の出るパターンはどのように決まる? (現在も未詳) ─┬→ 葉肉 mesophyll ─┬→ 柵状組織 palisade m. │ └→ 海綿状組織 spongy m. └→ 前維管束 precambium 葉脈 vein1973 Maksymowych: 柵状組織は一番後まで⇔方向分裂続く
海綿状組織: 一番先に分裂終了 → 海綿状組織引き千切られ間隙できる |
__________細胞間膜体積__Internal cell surface Leaf structure of C4 plant: 維管束鞘に葉緑体存在確認 生殖期における茎頂の変化
茎と根の関係 relationships between stem and root茎 ⇔ 根: 相互に交換可能: 全能性 totipotencyタンポポの根: 根 → 脱分化 → 再分化 → 茎 → 葉 3___________________________↘________↗ 再生、不定根、不定芽の形成は「脱分化 → 再分化」過程であり、茎 → 葉もこの範疇でとらえることができる [根の茎頂分裂組織との差異] 根の特徴
quiescent centerでは細胞分裂を行わない。発達段階における過去の発達過程を示す 側根形成・不定根形成1978 紫岡・下郡山・加藤
_
2-thiouracil(核酸合成阻害剤)を頂端に加えると不定根発生
15 hr IAA + 15 hr water
一次成長と二次成長 primary and secondary growth一次成長 primary growth: 茎端、根端発達によりできる組織 → 一次組織二次成長 secondary growth: 形成層からできる組織 → 二次組織 単子葉型肥大成長は稀。殆どの単子葉は一次成長のみ分類 頂端分裂組織 apical meristem 茎頂頂端分裂組織 shoot apex
栄養茎頂 vegetative shoot apex 根端頂端分裂組織 root apex 側部分裂組織 lateral meristem
形成層 vascular cambium
→ コルク形成層secondary tissue形成。表面細胞壊れる 木質部分化 differentiation of xylem= 導管vesselの分化成長点: dermatogen, peribrelm, pleromce 1968, 1970 Fosket: Coleus explants + Auxin
FdII: fluorodeoxyuridine (replication阻害) → TE分化抑制
pea root: cottical parenchyma → cytokininを加えないと分裂起こさない 1975 Torrey: Zinnia elegans: mesophyll free cell – no division 10% TE分化 → 細胞分裂は関係ない 1980 Fukuda & Komamine: suspension culture→ 48-96 hr - 分裂しないでTE分化 [DNA合成]1975 Shininger: pea root
Fu (fluoro-uracil), FudR (fluorodeoyuridine), mitomycin D, aphidicolin radioautographyでDNA合成観察されない → DNA合成は分化に無関係 1973 Avanzi et al.: Allium cepa
Need endoduplication and amplification of rRNA genes (rRNA)
キクイモ 2 c 4 c 8 c 16 c 3H-TudR: × 取りこみ, cell division: ×, TE分化: × ⇒ 矛盾 仮説: 一部の特殊なDNAが必須(証明なし) Sachs T: 材料Coleus 再生能力を示した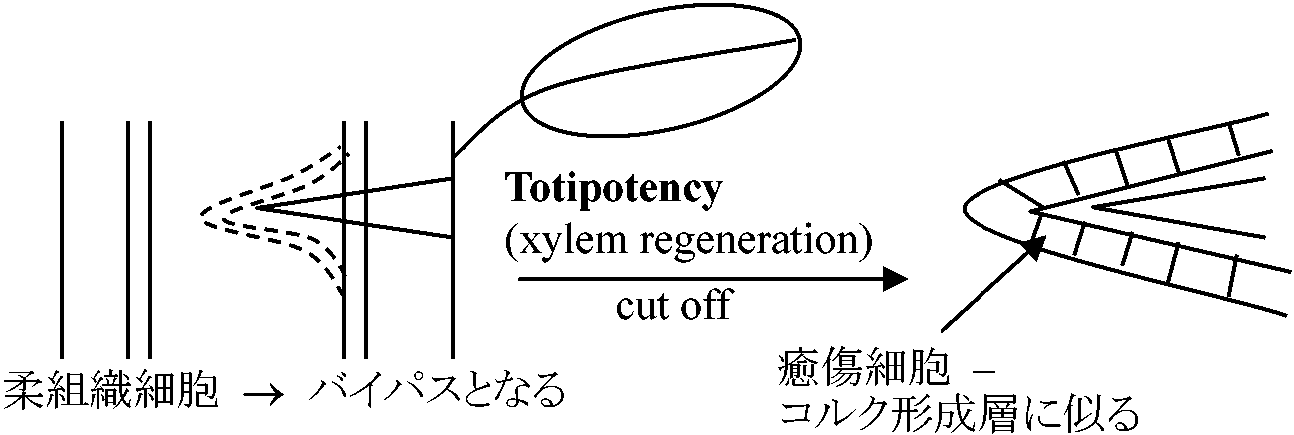 Jacobs: 葉除去する(葉がない)と非再生
→ 葉 = オーキシン供給源
Lilac (Syringa) callus → 脱分化 → 導管分化してくる → 芽からある一定距離を置いて導管分化 → 0.5 mg/lのauxinを加えるともっとも遠いところに導管形成 ⇒ Auxinの効果 1963 Wetmore & Rier1967 Rier & Besnon
Todea barbara (羊歯): 0.1% ショ糖 – 維管束できない AMP → [nucleotidase] → Ad + Pi 細胞成長(伸長)・分裂・分化 + 細胞異質性の起源と固定細胞分裂の終了した細胞は貯蔵器官ともいえる
キクイモ: 塊茎カルス → オーキシンを与えるとG1からSへの移行起こる G1からS移行はDNAにオーキシン影響したと予測
オーキシン作用でDNA量変化起こる様に見えない 植物成長過程へのホルモンによるコントロール = 細胞分裂・細胞伸長(拡大)・細胞系の変化 |
|
(器官)脱離: 植物器官が植物体から離れ落ちること
Ex. 落蕾、落花、落果、落葉、落枝 植物老化の4型
全体老衰 Ex. 一年生草本 落葉 defoliation(植物の一部が)落下せずについたまま枯れる marcescent落葉要因: 特定細胞節が離れること多(cellulaseがcell wallに働く可能性?) 季節的作用 = オーキシン分泌季節変化 = 離層を介しその両側のオーキシン濃度差が落葉に関与 エチレンが落葉の原因の1つ → エチレンはオーキシン合成に関与 ____└落葉はエチレン分泌のピーク後に起こる Auxin: surpress senescence, C2H4生産を刺激 → 離層にたまる
表. 落葉広葉樹林で葉からの養分転流 養分吸収と樹体内転流1) 養分吸収: 間接推定 → 根による土壌からの養分吸収量の直接測定はできていない年間吸収量 ≡ ΔY + ΔL + Rw
ΔY: 年間植物体増分量 |
2) 樹体内転流: 成長期に同化器官(葉)内に蓄積された養分を成長休止期に非同化器官へ引き戻すこと
葉養分含有率: 秋に低下 → リターフォール養分還元量は、成長期の葉中の養分蓄積量より少ない → 一部元素が降水により溶脱 + 落葉前に幹・枝・根に引き戻す 紅葉気温低下 → クロロフィル分解 → 離層形成葉に残るデンプンは離層により葉から移動不可 → 分解されブドウ糖となる 紅葉する細胞中はアントシアニジン存在 アントシアニジン + ブドウ糖 → [結合] → アントシアニン (赤色) さらに葉中に残るクロロフィルが分解され緑色が薄くなるとアントシアニンの赤色が目立つ = 紅葉落花 flower shedding開花後に花器全体が落ちる (落蕾: 蕾の段階で落ちる)= 胚発生ない状態の子房脱離 花器官での受粉と受精が確実に行われない → 落花 受精 - 落花抑制 ⇒ 落花率 - 種・個体群で大きく異なる ブドウの花振るい(花流れ)リンゴのカラマツ現象 離層発達と細胞壁分解酵素生成 - オーキシン減少、エチレン・アブシジン酸増加等が関与 落果 fruit shedding胚発生開始後の子房脱離果樹園芸では落花を落果に含めて扱うこともある |
|
花芽形成: 花序の形成過程も含める(s.l.) (☛ 光周性)
単頂花序 - 単一花芽形成 ↔ 多くは: 花序形成 → 花芽形成 (Meyerowitz et al. 1991) ABCモデル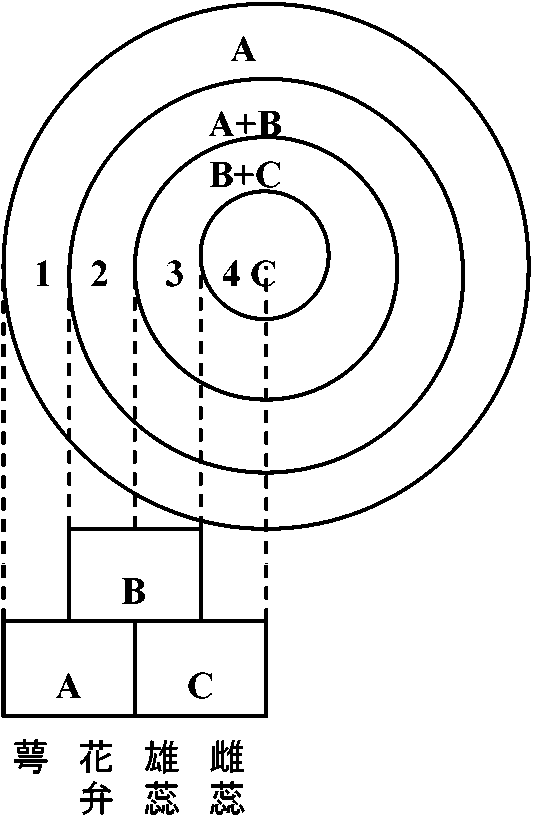 Arabidopsis (thaliana)
Arabidopsis (thaliana)
A = apetala (AP) 2 gene
ホール
1
2
3
4
ホメオティック突然変異体(ある器官がそれと相同な別器官に置き換わる変異) |
花形成制御遺伝子
MADS box → 花を形成しない動物や菌類・シダ類からも見つかる 開花 flowering夜開性 nygtigamy (anyctigamous: adj. flowers that open at night and close during the day) |