(2018年10月6日更新) [ 日本語 | English ]
HOME > 講義・実習・演習一覧 / 研究概要 > 小辞典 > 化学
[ プロトコル | 単位 | 培養・栽培 ] [ オートアナライザー QuAAtro 分析法 ]
分析目的定量分析 quantitative analysis ≈ 測定 measurementLord Kelvin (1824-1907) "If you cannot measure, your knowledge is meager and unsatisfactory." 定性分析 qualitative analysis状態分析 state analysis 対象物無機分析 inorganic analysis有機分析 organic analysis 試料絶対量常量分析 macro analysis: 0.1-数g半微量分析 semi-micro analysis: 10-100 mg 微量分析 micro analysis: 1-10 mg 超微量分析 ultra-micro analysis: < 1 mg 目的成分相対量常量成分分析 macro determination: 100ppm-100%主成分分析 major constituent determination: 1-100% 少量成分分析 minor constituent determination: 0.01-1% 微量成分分析 micro/trace determination: < 100ppm |
分析手法物理(機器)分析 instrumental analysis: 精度 ~1%化学分析 chemical analysis
重量分析 gravimetric analysis: 精度 ~0.5% 試料変化非破壊分析 non-destructive analysis試験管内分析 in-vitro analysis
試験管内等の人工的構成条件下 = 各種実験条件が人為的にコントロールされた環境であること
各種条件が人為的にコントロールされていない条件 ↔ in vitroと対比 Ex. 細胞内での反応 → その細胞が由来する生物個体内の本来あるべき場所における実験 ↔ in vivoも生体内だが、試験管等で培養された細胞内での実験を指すことがある |
コンピュータ分析 in-silico analysis: in silico (in vivo, in vitroからの派生語, シリコン(半導体利用)内で)
室内実験 = ウェットwet → 実験関連シミュレーション計算等をin silico (Bioinformatics分野) 破壊分析 destructive analysis目的成分分離の有無分離分析 separation analysis共存分析 non-separation analysis (cf. 同時分析multi-element/species analysis)
|
精度・確度: 実験値評価→ 確度・精度双方重要 (高精度測定 → 一方を意味か両方を共に含む意味)A) 絶対誤差 absolute errorある2つの測定値の差として表れる誤差 = データ信頼限界を示す定量的尺度同種物理量に関する2つの測定について、各々の絶対誤差が同じでも測定信頼度は一般に異なる Ex. 熊本-福岡間距離測定、廊下幅測定 → 絶対誤差が共に20 cm → 測定信頼度に大きな差 1 確度 (正確さ) accuracy: 真値 true value (承認値)に対する実測値(測定値)の絶対誤差 = 偏りの程度
不確かさ uncertainty: "真値"が記述された信頼水準で確実にその内にあるといえる値の範囲を推定したもの 最確値: 承認値不明で実測値間比較のみ可能 → 同一条件下で得た実測値の代表値(通常平均値) 測定値と同単位を持つ 3 感度 sensitivity (sensibility) 物質量の変化に対する信号の変化の割合→ 検出限界 detection limit: どの程度の量で検出できるか (4) 選択性 selectivity多元素(多成分)共存試料中、目的成分のみを定量する識別能力 B) 相対誤差 relative errorある測定の持つ誤差を、測定値に対するその絶対誤差の比(%表記が一般的)
相対誤差は同じ単位を持つ物理量の比 → 無名数 絶対誤差1. 系統誤差 systematic error測定値が承認値より常に同じ分のずれを測定 → その一定の絶対誤差 |
系統誤差は注意深い実験により除き得る 2. 偶発誤差(測定誤差) accidental error (random error)同一測定系測定値でも測定値ごとに生じる誤差原因不定 → 補正不可 有限回数測定を有意義にする → 偶発誤差を合理的・定量的に見積る必要 測定値の偶発誤差の見積 → (たまたま測定された)最大誤差でなく合理的最大誤差に基づくべき
Ex. 目盛の1桁下まで読む測定: [経験] 多数人測定結果から最小目盛 ± 0.2が偶発誤差(視差)見積に有効
2測定値m1、m2とその誤差を± e1, ± e2 → それらの和(差)の誤差Es、及び積(商) Mpの誤差Ep SN比(S/N比) signal to noise ratio(欲しい)信号と雑音の比 → S = signal, N = noise (信号の分散)
= D/U ratio: desired signal to undesired signal ratio デジタル誤差指示値(表示値・読み値)誤差 reading, rdg: 現在測定中の値そのもの分解能誤差digit, dgt: デジタル計器における最小表示単位 Ex. 確度 ± 1.5% rdg ± 4 dgt → テスタで100.0 Vを表示
rdg誤差 100.0 × 0.015 = 1.5 V |
参照物体reference objectものの位置(右・左等)を決める基準物体 ⇔ 指示物体エタロンetalon単位(量)の1-複数値参照に定義、保存、実再現意図 → 実量器・計器・標準物質・測定システムEx. 1 kg質量標準器、100 Ω標準抵抗器、セシウム周波数標準器、標準水素電極、認証濃度標準溶液
群標準 collective standard: 組合せ使用し1標準を構成する類似した実量器又は計器の群 国家標準 national (measurement) standard: 国家的承認標準で当該量他標準に値付けする基礎とし国内使用 一次標準・二次標準一次標準 primary standard: 最高計量性能持ち、同一量他標準参照なしに値が受容される標準。一次標準概念は基本量及び組立量に対し同等に有効二次標準 secondary standard: 同一量の一次標準と比較し値決定した標準
参照標準 reference standard: ある場所(組織内)で最高計量性能をもち、そこで行われる測定の基になる標準 仲介装置transfer device: 仲介として用いる装置が標準でない場合 移動用標準 traveling standard: 地域間輸送時特別製標準 Ex. 可搬型電池駆動式セシウム周波数標準器 トレーサビリティtraceability(adj. traceable): 不確かさが全て表記された、切目のない比較の連鎖 traceability chain を通じ、通常は国家標準又は国際標準で決められた標準に関連づけられ得る測定結果と標準値性質 |
校正(較正) calibration計器(測定システム)での値、もしくは実量器(標準物質)で表される値と標準により実現される対応する値との間の関係を特定条件下で確定する一連作業
校正結果は、指示に対する測定量の値の指定、又は、指示に関する 補正の決定を可能にする
測定標準の計量特性を適切な限界内に維持に必要な一連作業 標準物質 reference material (RM)機器校正、測定法評価、物質値付けに用いる1つ以上の特性値が十分に均一で良く確定された物質や材料標準物質は純粋な又は混合した気体、液体、固体の形で存在し得る Ex. 粘度計校正水、熱量測定において熱容量校正に用いるサファイア、化学分析校正に用いる溶液 認証標準物質 certified reference material, CRM特性値表現に用いる単位の正確な現示へのトレーサビリティが確立され、かつ表記された信頼水準での不確かさが各認証値に付される手続きにより、その1つ以上の特性値が認証された認証書付き標準物質認証標準物質: 通常バッチで作成 → 特性値はバッチ代表試料測定で表記した不確かさの限界内で決定 → 特性は、その物質が特別作成装置に組み入れられる時、便利かつ信頼できる形で現示される場合がある Ex. 三重点セル中に入れる三重点既知物質、透過フィルター用光学密度既知ガラス、顕微鏡スライド上に載せた均等粒径球状粒子 = 装置は認証標準物質とみなせる 全認証標準物質は"国際計量基本用語集(VIM)"にある"測定標準"の定義の枠内に入る標準物質・認証標準物質: 確定した化学構造に関連づかないか、他理由により厳密に定義された物理的化学的測定方法では決定できない特性 = WHOが国際単位に付与するワクチン等、生物学的な物質も含む (ISO Guide 1992) |
1) 法則自身が(ある意味で)近似a) ニュートン力学: "遅い"運動で成立→ "速い(光速近く)"運動で不成立 → 相対性力学の方が高精度 b) フックの法則 Hooke's law: のび ∝ F (限界がある) |
2) 実際に問題を解く時に近似を使うEx. 振子 pendulum周期 ≡ mlδ'(t) = -mgsin(δ(t)) → この微分方程式を解くのは難しい
sin近似式, sin(δ(t)) ≈ δ(t), δ(t) < 1: 揺れ幅が小さい(微小振動)とした近似 → mgδ'(t) ≈ mlδ(t) |
|
数値信頼桁数: 測定誤差 measurement error → 近似値 approximate value 同一条件測定にばらつき → 算術平均(相加平均) ± 標準偏差
sf以下の数字は無意味 Ex. 測定機機・器具最小目盛の1/10まで読むと末位数字は目測見積数
Ex. 35.4: sf 3桁 = ±0.05(の曖昧さ) ↔ 35.40: sf 4桁±0.005 有効数字末位計算
35.4 + 0.354 = 35.754 → 35.8 |
Ex. 42.68 × 891 / (132.6 × 0.5247) = 546.57 末位の6はそれがかなりの曖昧さを含むことを示すため下付き表示。キーナンバー自体に1/891の不確かさがあり、解も少なくとも6/5466 (= 1/911) の不確かさがある 乗除算では最終解が有効数字を保つよう各々の計算各段階の解は丸めを行うこともある。しかし、最終解の信頼性保持には有効数字末位2(1)下の桁の数字を含め計算を行い、最後に丸める 収率 efficiency, E (%) ≡ (収量/理論収量) × 100理論収量: 出発物質(原料)が反応式に従い理論的に生成する目的化合物量収量: 実際に得た生成物量 基準原料: 合成実験では、原料 starting material に対し試薬 reagent を等モル以上に過剰に加え原料を効果的に生成物に変換させる。複数原料を用いる場合は、理論収量計算は反応主体的構成原料を基準に採る → 反応の性質によっては基準物質が紛らわしいため基準原料を明記Ex._原料: C6H6, Mw = 78.114
試薬: HNO3 (H2SO4)
C6H6 → C6H5NO2 有効数字上は正 → 実際は出発物質が副反応を起こさず反応式通りに目的物を得ることは少ない。反応後の分離精製(再結晶、蒸留、抽出等)でも損失があり、小数点以下の数字は無意味で、収率は52%と記す 参考: JIS規格, 数字の丸め方 |
≡ 試料紛失・実験機故障等でデータが予定通りに得られないこと
解決法欠測値推定行い、最適条件を推定し確認実験する最適設計と現行(初期)条件の差分である利得の推定値と確認実験の値がほぼ一致すれば、下流への再現性が確認でき、欠測値がある場合でも最適条件を決定すること可能 逐次近似法: 汎用性の高い欠測値処理法
|
「悪すぎ計測できない」 ≠ 欠測値 「物ができず(反応起こらず)測定不可」 → 技術的理由でデータ取れない時は、悪いという情報であり欠測値ではない。他SN比平均値を使用せず一番低いSN比に -3 db(分散で2倍悪いと仮定)を第0次近似値とし逐次近似法使用 「データ良すぎSN比変換不可」 ≠ 欠測値 望目特性で誤差因子水準を変えても、データが全て同値をとるとか、望小特性でデータが全て0等はSN比無限大になりSN比変換できない。その制御因子の組み合わせを理想状態とし解析せず最適条件を決めてもよいが、各因子主効果の傾向を一応解析し確認実験を行う → 実験No.データを異なった値に修正しSN比変換後、各実験No.中で一番高いSN比に+3 db加えた値を第0次近似とし、逐次近似法処理 → 生データで誤差因子に定性的傾向確認(データモニタリング使用が良い) → 誤差因子効果がなければ実験見直し必要 |
|
一定の目的を達成するために定められた手順やルール
調査プロトコル:野外調査や実験の際に用いる標準化された手順書 実験プロトコル (experimental protocol)実験・調査の手順、条件等を記述 - 再現性・統一性・安全性これをもとに実験調査を行えば再現性が確約されねばならない。論文とかには書いてない、操作のコツも書いてあることがある ちなみに、京都議定書は、英語ではKyoto Protocol (正式には「気候変動に関する国際連合枠組条約の京都議定書(Kyoto Protocol to the United Nations Framework Convention on Climate Change」) |
[植物科学の新展開 -分子から群集まで広視野研究をめざす-]
|
サンプリング (植物)サンプル量
分析必要試料量 (測定機器の制限 試料乾燥1) 通風乾燥 70-105°C → 重量一定(普通2-3日)
試料多い場合は紙袋等、少量の場合は薬包紙、秤量管等に入れて乾燥 |
2) 凍結乾燥 (凍結乾燥機マニュアル 試料調整試料粉砕: 抽出効率の向上とサンプル均一化の2つの目的で行われる粉砕必要ない(しない方が良い)場合 Ex. 少量試料(組織) - 粉砕ロス大 大量サンプル(> 100 mg) → 粉砕器数mg-10mg → 粗粉砕試料の一部をボールミル等を用いさらに破砕 試料様態
↔ ロースループット: 単純化もしくはミニチュア化することができず、人力により行なう職人的評価系 |
分析基本 = 器具十分洗浄 → 疎かにすれば優れた技術でも正確な分析無理
使用後なるべく早く水や適当な溶媒で濯ぐ(長時間放置 = 汚れ落ちない)すぐ洗浄できない時は、せめて水や適当な溶媒につけておく器具洗浄方法: 洗浄器具の使用目的、方法を十分検討した上で行なうEx. COD測定は、家庭用洗剤使わず、硝酸(塩酸)-過酸化水素水混合溶液を用い、最終的洗浄は3回蒸留水で完全に洗浄水を洗い落とす
|
試薬・器具保管(一般事項)使用後の空瓶は(洗浄し)定められた場所に保管 (洗浄不可なものもある) |
分離方法
|
|
有機化合物成分元素検出C, H(乾燥)試料 + CuO* (酸化銅II) → [加熱] → CO2 + H2O (*: 粉末)
CO2: Ca(OH)2水溶液, Ba(OH)2 [有毒]水溶液 → 白濁沈殿 N試料 + NaOH or ソーダ石灰a → [加熱] → NH3a: NaOHとCaOを水で練り乾燥させたもの。CO2吸収剤や炭素化合物分解剤に用いられる NH3: 1) ネスラー試薬橙黄変, 2) 濃塩酸で白煙, 3)臭い S試料 + 金属Na → [加熱分解] → Na2SNa2S + H2O + CH3COOH + Pb(CH3OCC)2 → PbS (黒色) 試料 + 水酸化Na → [加熱分解] → Na2SNa2S + Pb(CH3OCC)2 → PbS (黒色) 試料 + 蟻酸Na → [加熱] → H2SNa2S + 酢酸鉛紙 → PbS Cl (主にハロゲン)銅線に試料つけ無色炎加熱 → Cuとハロゲンが化合しハロゲン化銅→ 青緑色炎色反応 |
簡易定量分析Case. C, H, O実験式(組成式 – 元素分析からは組成しか求められない)x:y:z = (C原子数):(H原子数):(O原子数)
= (C質量)/12:(H質量)/1:(O質量)/16 → 88 mg CO2, 54 mgH2O生成 A.__C: 88 × 12/44 = 24.0 mg
H: 54 × 2/18 = 6.0 mg ClHmOn + xO2 → lCO2 + m/2·H2O → n + 2x = 2l + m/2 (xが求まる) Ex. 2l C2H2 (アセチレン) + 30 l air→ 完全燃焼後体積(水は体積0とする) (A. 29 l) Ex. CH2Oの実験式を持つ主要物質
n (分子量)
示性式
|
ペーパークロマトグラフィ (paper chromatography, PC)色素分析植物色素分離・同定・精製有効手段 → クロマト(グラフィ)Ex. ペーパークロマト、薄層クロマト、カラムクロマト ペーパークロマト: 1枚の濾紙片を吸着剤とし微量物質を吸着させ、一方向から溶媒をしみ込ませ分離する方法操作: 1. 試料液作製 → 2. 濾紙片へ試料吸着 → 3. 溶媒展開 → 4. 物質検出、Rf値計算、成分判定 操作法から一次元法、二次元法や上昇法、降下法等に分類される
┏┓ paper 試料溶液を濾紙の下部につける → 原点 濾紙を適当な容器に吊るし密封 (濾紙下部が1-2 cm程度展開液に浸るよう) 原点側から展開液は徐々にしみ込む → 試料溶解度差等で分離し濾紙上の異なる位置を占めるようにする 特徴 試料少量でよい 操作容易かつ比較的短時間で結果得られる Rf値rate of flowは、ある溶媒について他物質の存在に関係なく一定 可溶性で不揮発性のほとんど全ての化合物に適用可 Ex. 葉緑体色素、花弁色素、アミノ酸 目的: 光合成関与色素の種類と性質を調べる 準備
培養・微生物学実験で、細胞懸濁液調製に用いる。生化学・分析化学で、定量用試薬混合や、試料の均一な倍散に用いる 試料吸着・展開
色素 chl a chl b lutein violaxanthin neoxanthin carotene アデニン・ヌクレオチド (adenine nucleotide) 分離・同定試料: ATP, ADP, AMPのNa-salt solution準備: filter paper (Toyo #51A) 検出試薬
1 N NaCl__________________10 ml |
操作
1) H2Sの変りにCS2を用いる。以下は4に同じ 展開液 Pi PPi AMP DP TP アセトン:35%蟻酸 = 3:2 0.70 0.40 0.24 0.11 0.04 イソ酪酸:水:酢酸 = 100:50:1 - - 0.43 0.22 0.15 → 分光光度計による測定 薄層クロマトグラフィー thin layer chromatography, TLC脂質分析板: シリカゲル wed. 0.25 mm (5 × 20 cm) Merk → 薄層材料: 精製脂質標準試料: GL (cardiolypin), PG (phosphatidyl glycerol), PE (phosphatidyl ethanolamine) 展開液:
展開操作
ガスクロマトグラフィ (gas chromatography, GC)移動相が気体であるクロマトグラフィ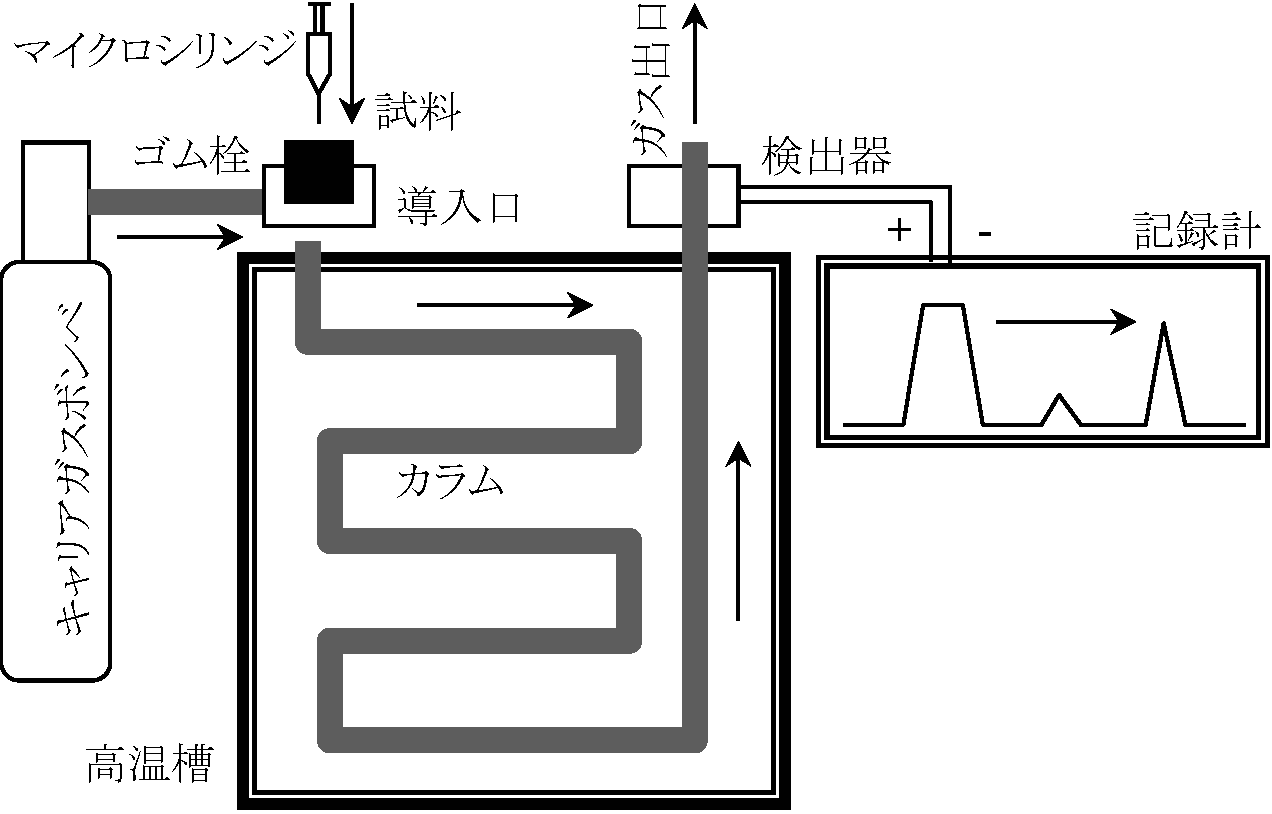 図. ガスクロマトグラフィ カラム: 沸点が高い(> 400°C)油状の液相物質(= 固定相)を染み込ませた多孔質の粉体を充填 適切な温度に設定したカラム中にキャリアガス(Ex. He)を流す 導入口から試料を瞬間的に導入すると試料は気化しキャリアガスとともにカラム中を通過充填剤に吸着されやすい物質はゆっくり移動(逆も真) → 分離過程 検出器: キャリアガス以外が通過すると電圧変化として検知 →ピーク面積 ∝ 質量 → 定量可 Ex. 脂肪酸組成決定: μg単位微量分析 = total lipidsに対し1 mgで分析可能方法
前処理:
Injector temp.: 240°C, Detector temp.: 235°C, Column: glass column φ = 3 mm × 2 m |
0. 簡易タンパク質検出キサントプロテイン反応: condensed HNO3 + heat → 黄ビューレット反応: NaOH + CuSO4 → 青-赤紫 1. 分離・識別利用形質 = 大きさ(分子量)、溶解性、電気的特性、吸着、生物学的親和性等大きさ(分子量)a) 透析 dialysis: 半透膜孔(普通は20-30Å)を通しサイズ推定
___________________________コロイド粒子は内に残る c) ゲル濾過 d) 密度勾配遠心法 [別掲] 溶解性a) pH: 両性電解質(Ex. タンパク質)は溶媒pHにより正負電荷数が変化Def. 等電点 isoelectric point, pI: 特定pHでは正負の電荷数が等しい ≡ 全体として電荷を失う時のpH Ex. pepsin 1.0, lysozome 11.0 Def. 等電点沈殿: 等電点(で溶解度最小)を利用しタンパク質等を沈殿b) イオン強度, I = 1/2Σcizi2
i: 電解質溶液に含まれるイオンのうちi番目のイオン ⇒ 塩溶 salt-in・塩析 salt-out 塩析: 溶液中に溶けた物質を溶液に塩類を加え、高濃度塩により溶解度が減少することを利用し析出させる。変性の恐れのない沈殿法だが、沈殿に多量の塩を混入するから脱塩、濃縮等の事後操作が繁雑となる。タンパク質の水に対する溶解度は塩濃度が薄い間はイオン強度Iに比例し増加するが(I = 0-1間: 塩溶効果)、更に塩濃度が増すと溶解度は(1.1)式に従い減少するlogS = β – KsI … (1.1)
S: タンパク質溶解度
イオン強度Iは CとAは陽イオンと陰イオンのモル濃度、xとyは各イオンの原子価 c) 有機溶媒 (万全の注意): 有機溶媒を加え溶液誘電率を下げたタンパク質沈殿方法は変性危険性高いが、大量試料調整に適d) 誘電率 e) 温度 電気的特性a) 電気泳動 electrophoresisb) イオン交換クロマトグラフィ イオン交換樹脂やイオン交換セルロース等を固定相として用いる アミノ酸・ペプチド・タンパク質・リン酸等の生体由来のイオン性物質(中性糖の場合も核酸の複合体として)の分析に使う。試料各成分の挙動は主として固定相中の解離基との間の静電気的相互作用の大小によって支配されるが吸着力などのほかの因子の関与も無視できないことが多い -CHCOO-: carbonylmethyl (CM)-CH2CH2N + (CH2)2: diethylaminomethyl (DEAE)
|
生物学的親和性 affinity chromatography酵素(生体タンパク質の90%が酵素)の基質特異性の高さを利用
Acethylcholin esterase CH-N(-CH3)2-(CH2)2O-C(=O)-CH3
┣ 基質E
コイ4匹 = 6 kg → 白身4 kg → 白身 + 0.3 mol 砂糖水(3:1) → 遠心分離(7000 rpm, 30 min) → 上澄を透析 (3.5l) → 遠心分離 → 上澄を硫安沈殿(70-100%飽和) → 透析 → 濃縮 200 ml 2. 分子量決定化学分析: タンパク中の金属(イオン)等定量 → タンパク質全体の分子量推定
Mb(ミオグロビン)の鉄含有量は0.33g (Fe = 55.847)
a) 浸透圧 osmotic pressure b) 沈降 sedimentation (超遠心分析法) → 遠心分離器(機) タンパク質定量法ローリー法 Lowry's methodブラッドフォード法 Bradford's method → よく使用される(た) 両方法による定量法の長所、短所を血清アルブミンを用い比較してみる ブラッドフォード法染色液Cosmassie Brilliant Blue G-250 (色素とタンパク質の結合酸は青色呈色) 200 mg(w/v)(本実験はv/vで代用) 95% Et-OH 100 ml中に溶解(w/v, 同) Add 85% Phosphoric acid 200 ml 以上のものを使用時にH2Oで5倍希釈使用 (溶液寿命1週間程度) 操作 10-100 μg protein (=0.1mg) → Add 5 ml dilute dyeing solution → 2 min - 1 hr → Ab595 Bradford. 1976. Analytical Biochemistry 72: 248-252 タンパク質定量方法: サンプルを適当濃度に稀釈し2方法(Lawry vs Bradford)により吸光度を調べタンパク質含有量を測定試料: 未知のアルブミン溶液 C1, C2, C3, グレープジュースの4種 結果:
試料 C1 C2 C3 Grape juice
Lowry's Mmethod
希釈率(×) 60 15 60 100
吸光度(平均) 0.440 0.536 0.303 0.675
含量 (μg) 77 96 50 123
濃度 (mg/ml) 7.7 2.4 5.0 20.5
正しい値 6 2 4
MMB Method
希釈率(×) 10 2 10 1
吸光度(平均) 0.4615 0.7055 0.3955 -
含量 (μg) 63.5 106.7 52.0 -
濃度 (mg/ml) 6.35 2.13 5.2 -
正しい値 6 2 4
|
|
[ 流体力学 | 拡散 ] 遠心分離 (centrifugation)遠心分離器/機 (遠心器) centrifuge, centrifugal separator (machine)スイング式ロータ 10000回転/min___アングル式ロータ: 20万回転/min
rmax: 最小回転半径 ↔ rmin: 最大回転半径 (スベドベリ 1926) 超遠心分離器 ultracentrifuge
沈降理論沈降速度: 比較的速く回転させ流れているものを測定 (普通1-2時間)沈降平衡: 比較的遅く回転させ沈降速度一定になるのを待ち測定 (1-2日) 沈降速度 sedimentation velocity遠心力(fr, g)と回転数(N, rpm, revolutions per minute)の関係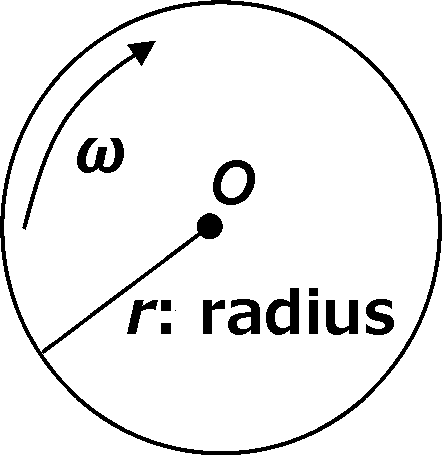 i) 遠心力: fr = mrω2
i) 遠心力: fr = mrω2Def. 相対遠心加速度 relative centrifugal force, RCF ≡ αr/αg (G or ×gをつける)
αr: 相対遠心加速度 = rω2 = r·(2πN/60)2
= {r·(2πN/60)2}/980.665
If rmax = 15.4 cm and Nmax = 5000 rpm → 4304.3 (粒子容積) × (溶媒密度) × gw2 m/g × (偏比容)/cc/g = mv–vρ 偏比容: 1gの乾燥溶質を加えた時の増加割合 ⇒ fr = mv–ρrω2
分子にかかる遠心力(fr')は (i)(ii)の和 Def. 完全球体粒子に対する沈降力 setting force, fc fc = (粒子体積, cm) × (相対密度) × (遠心加速度) = (1/6·πd3)·(σ - ρ)·(rω2)
d: 粒子直径 (cm) σ: 粒子密度 (g/c), ρ: 溶液密度 (g/c) Law. Stokesの法則 (Stokes's law): 摩擦係数 frictional coefficient, ffff = 3πdηv
η: 溶液粘度 (poise: g/cm/s)
∴ 1/6·πd3·(σ - ρ)·rω2 = 3πdηv S (スベドベリ単位 Svedberg unit) = s × 1013 (見やすくした)
v = S·rω2·10-13
S or S20, w: 通常は20°Cでの沈降
沈降時間 settling time, TT: 粒子がrminからrmaxまで移動する時間v (沈降速度) = dr/dt = s·rω2
T = ∫rminrmaxdr/dt
= (2.53 × 1011)/N2·ln(rmax/rmin) A. T (hr) = K/S = 20/5 = 4 (hr) 補正: 試料濃度・粒子形状・温度の影響試料濃度: 球状粒子で低濃度(数%以下) → 無視できる 非球状粒子 - 濃度1%増加ごとにS値は5-10%低くなる 粒子形状: 球に近似できる範囲では無視できる楕円体 - 直径比が高くなるにつれS値は低くなる 温度: m = 溶液 → T = 温度、S20, w → ST, m)ST, m = S20, w·(σ - ρT, m)/(σ - ρ20, w)·(η20, w/ηT, m)
ρT, m, ρ20, w: T°Cでのmと20°Cでの水の密度 (g/cm3) [流体] 拡散 diffusionD = RT/Nf (D: 拡散係数 diffusion coefficient)f = RT/DN ∴ S = m(1 - v-r)/(RT/DN) = DN·m(1 - v-ρ)/RT m: molecular mass, Nm: molecular weight) ∴ M = SRT/D(1 - v-ρ)M: 分子量 ⇒ Dが求まれば分子量が求められる Fick, Adolf Eugen (独, 1855) フィックの法則 (Fick's laws of diffusion)第一法則: 定常状態J = -D·(dρ/dx)
J: 拡散流束 flux ∂C/∂t = D(∂2C/∂x2 + ∂2C/∂y2 + ∂2C/∂z2) アインシュタイン(-スモルコフスキー)の関係式Einstein or Einstein-Smoluchowski relationD = μkBT
μ: 移動度 沈降平衡流れの方向に直角な界面AAを横切る粒子の流れ CA(dr/dt) … (1) 拡散による逆向きの流れ -DA(dc/dr) … (2) C: タンパク質濃度. A: 界面面積 |
(1)(2)の総和が0 → dm/dt = CA(dr/dt)
参考: dr/dt = mr;ω2(1 - v-ρ)/f {Cmrω2(1 – v-ρ) } = D·dc/dr∫dc/c = Mω2(1 – v-ρ)/fD·∫rdr ln(C1/C2) = Mω2(1 – v-ρ)/RT·1/2(r22 – r12) M = RTω2/(1 – v-ρ)·1/2·(r22 – r12)·ln(C2/C1) ⇒ M: 分子量が求まる タンパク質を例に 生化学的分析a) ゲル濾過 gel filtration: 操作は容易だが不正確
Kp: タンパク質分子量に対応しているのではなくStocks半径に対応。全てが球と仮定した時の分子量 ゲルの問題点 → 普通Sephadex(商品名)使用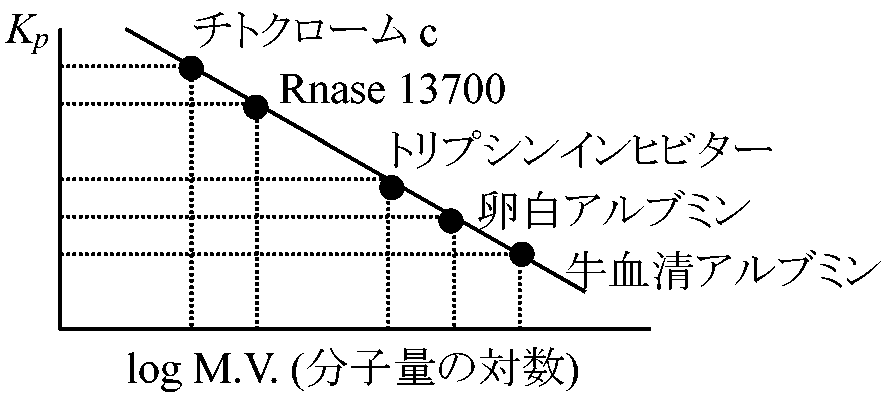
多糖類に影響するのでチャージを作ってはならない
__________ O 条件が一定の時は電荷および分子の形、大きさにより泳動速度が異なる点を利用 複雑な構造のタンパクを分離し調べる時に便利 SDS (sodium dodecyl sulfate)中で行う ポリアクリルアミドゲル
i) HC=CH-CO-NH2 →
重合剤: (NH4)2S2O4, N,N,N',N': テトラメチルエチレンジアミン
ii)
濃度測定秤量、紫外線吸収法a) ケールダール(キールダール, Kjeldall)法 総窒素量定量に広く用いられる方法 → 窒素量をもとにタンパク質量推定 (→ タンパク質濃度そのものの定量としては不正確) b) ビューレット(biuret)法: 主鎖ペプチド量を調べる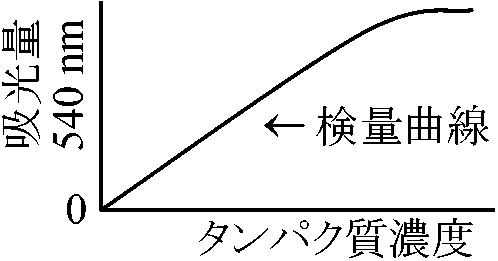
Cu++ + peptides → 紫色( = 540 nmに吸光がある)に呈色 本法全てに言えるが最初の含量が不明の時には相対値のみしか得られない d) 最少分子量Fe ion: Fe 1 mol = protein × mol のように相対値が得られる e) 秤量: 乾燥して目方を計る実験が正確であれば最も正確でしかも絶対値で求められるが、加熱の際に燃焼したり、親水性の強いものは乾燥不十分であることが多く計測値に大きな誤差を含みがちである f) フェノール法H3PO4 + 12H2MO4 (モリブデン酸)
→ H3Mo12PO4 + 12H2O (リンモリブデン酸) 細胞壁成分の抽出・分画植物組織┃磨砕、冷水抽出 ┃濾過または低速遠心 ┣━━━━━━━━━━━━━━━━━┓ ┃エタノール・エーテル抽出 冷水可溶性分画(+ 細胞質顆粒) ┣━━━━━━━━━━━━━━━━━┓ ┃(脱リグニン処理) 脂質 ┣━━━━━━━━━━━━━━━━━┓ ホロセルロール (リグニン) ┃0.5%熱シュウ酸アンモニウム抽出 ┣━━━━━━━━━━━━━━━━━┓ ┃17.5%NaOHまたは4N KOH抽出 ペクチン分画 ┣━━━━━━━━━━━━┓ αセルロース(β1, 4-グルカン) ヘミセルロース分画 ┃弱酸性(酢酸)で沈殿 ┣━━━━━━━━━━┓ ┃80%エタノール沈殿 ┃ ヘミセルロースB ヘミセルロースA (βセルロース) (γセルロース) クロマチン分離法エンドウ発芽幼胚核に当量の62 μmのガラスビーズ加え激しく振盪し核を破砕10倍量0.4 Mショ糖, 0.5 mM CaCl2, 0.1 M K-リン酸緩衝液, 0.1 mM MgCl2, 5%フイコール, pH 1.2に浮遊 低速遠心でガラスビーズを除く
↓ 遠心 1200 × g → 沈殿(核小体) → ER分離法 |
|
電荷持つ物質が、その溶液に電場を加えた時、一方の極に向かい移動 陰極に向かえば正、逆なら負の符号。高分子物質移動度は共存電解質イオン濃度や種類、測定温度等の影響を受けるが、条件一定なら電荷及び分子の大きさ、形状に左右される ⇒ 電気泳動は蛋白質等生体高分子研究手段として、混合物分析、精製試料純度検定に欠かせない 蛋白質の電気的性質蛋白質 = アミノ酸集合体 → アミノ酸同様、両性電解質*の性質蛋白質等電点**より酸性側溶液ではプラス(+)に、アルカリ側ではマイナス(-)に荷電する。蛋白質の電荷を構成する酸性アミノ酸:塩基性アミノ酸比率のみから直ちに推定することは出来ない。蛋白分子は複雑な立体構造を有しており、分子内側にある解離基は分子表面にある解離基に比し蛋白分子全体としての荷電への影響が少ないからである。なお、蛋白分子が単位電場で1秒間に移動する距離(cm: 易動度)は分子の荷電に正比例する
*: (-COOH ⇔ -COO- + H+)(-NH2 + H2O ⇔ -NH3+ + OH-) 電気泳動の種類ゾーン泳動法: 濾紙やポリアクリルアミドゲル等の支持体内に試料溶液を添加し、その動きを観測する。ゲルを支持体に用いると一種の分子篩的効果が加わり高い分解能得られる。今回は支持体としてセルローズアセテート膜を用い3種類の動物血清蛋白質を分画する
血清蛋白はいくつに分画されるか 血清タンパク電気泳動= 電気泳動による蛋白質の分離セルローズアセテート電気泳動法による血清蛋白分画1) 両電極にベロナール buffer sol.を各200 mlずつ入れる2) セルローズアセテート膜(セパラックス)に柔らかい鉛筆で線と番号記入する
膜面が湿ったら(半透明化)静かに沈める |
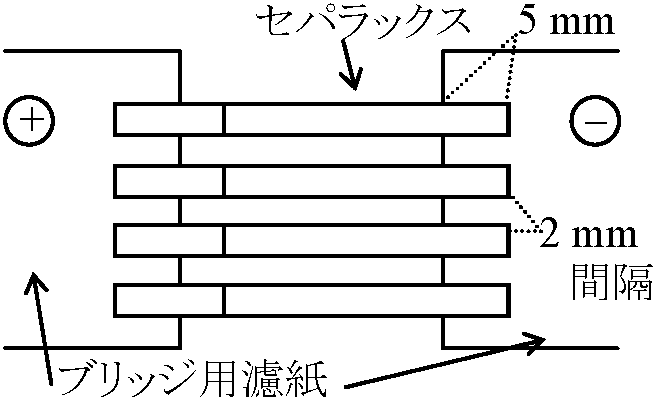
4) ブリッジ用濾紙を電極槽のBufferで濡らし支持(保持)板内側の長片を揃えて貼る。支持板の部分にBufferを注ぎかけてから気泡を残らず押さえ板で追いだす(上完了図参照) 5) Bufferに馴染ませてあったセパラックスを取出し、濾紙に軽く挟み余分の液を除いた後、速やかに支持台に載せる。支持板(ブリッジ用濾紙)と重なる長さは5 mm、セパラックスの間隔2 mm 6) 押さえ板を、液が逃げ出さないよう静かに置き、ガラス蓋をする7) 通電テスト
↓ 定電流・電圧装置(stabilizer) (一枚当り0.8 mA。8枚なら6.4 mAに調節) 10分後、電流・電圧の安定度を確認した後 CONTROL - : SELECTOR – SB: POWER - OFF 8) 試料塗布
↓ ガラス蓋を密閉
(※赤のピンセットでセパラックスを移していく) 12) 乾燥したら流動パラフィンでセパラックスを透明化(3参照) ※黄色のピンセット 13) アクリル板に挟んでデンシトメトリーにかけ記録をとる |
|
= アミノ酸結合順序決定 a. 異なるポリペプチド鎖の分離 N端の数からポリペプチド鎖数を推定。濃塩を用いカラム分離 b. ジスルフィルド(S-S)結合の還元と-SH基のアルキル化: -SH, -S-S-
加水分解の典型的方法(酸分解) → 6N HCl, 100°C (封置), 20 hr d. N末端のアミノ酸の決定 - DNFB, dansyl chloride, Edman method
色素がついているのでクロマトグラフィで検出できる
蛍光があるので少量でも検出できる 1-dimethyl aminonaphatene-5-sulfonyl chloride 1949 Edman
Phenylthiohydantion (誘導体) → ガスクロマトグラフィーで解析 ※自動化機械(シークェネーター)sequanatorで20個程度のアミノ酸配列を決定できる e. C末端アミノ酸配列の決定
LiBH4, Hydrazinolysis, 酵素(carbonylpeptidase) → -CO-NHNH2, H2N: C端がわかる (H2NCHRCOOH) f. 断片化fragmentation
化学的手法 - CNBr(シアノゲンブロマイド) → Met C-sideを切断 |
i) CNBr
α) キモトリプシン chymotrypsin
二次元展開: カラムクロマトグラフィー・電気泳動(二次元)・薄層クロマトグラフィー h. 断片シークエンシングfragment sequencingi. オーバラップ度チェック j. -S-S-, -CONH2の決定 プロテアーゼにより残基を分離後クロマトグラフィーによって決定 インシュリン insulin 配列決定(Sanger F 1955, 英. 1969年ノーベル賞, DNA, RNA配列決定手法も開発) 1949-51: B鎖構造決定を始め30個のアミノ酸配列決定ペプチド末端に標識化合物を結合させインシュリンを様々な長さの部分ペプチドにし、クロマトグラフィーにかけ配列決定 1953: A鎖について発表(グルタミン酸とグルタミン、アスパラギン酸とアスパラギンの決定は難しい) 1955: インシュリン全構造発表
タンパク質のアミノ酸配列決定法開発 → タンパク質化学出発点とし評価 タンパク質が化学的に均一で独立分子であることを実証。タンパク質数51、サブユニット2、分子量5732。膵臓ランゲルハンス島β細胞から分泌され血糖量を減少させる
+ GIVFQCCASVCSLYQLENY CN -
| |
S S-S
| |
+ FVNQHLCGHSLVEALYLVCGERGFFYTPKAQ -
|
|
核酸 nucleic acid → [加水分解(化学的・酵素的)] → base, nucleotide, nucleoside → 分離・定量 → ■分析
■分析手法: カラムクロマトグラフィー(C)、ガスC、濾紙C、薄層C(TLC)、濾紙電気泳動 1) 加水分解i) RNA, ribonucleic acida) 酸(現在利用されない)
1.2 N HCl, 100°C, 1 hr → G, A, poly C, poly U [G, A(プリン塩基)まで分解]
0.3 N NaOH, 37°C, 18 hr → 2' and 3' mononuculeotide
RNase T2 (特異性無), pH 4.6, 37°C, 3 hr → 3' monocucleotide (Np) |
ii) DNA, deoxyribonucleic acida) 酸による: 6N HCl, 100°C, 3 hrb) 酵素 (表. 各種酵素による加水分解条件) DNA → [DNase] → オリゴヌクレオチド (pN)m → [PDase] → pN (ウシ膵臓デオキシリボヌクレアーゼI) c) Deoxyribonuclease (DNase I)DNA → [DNase I, pH 8.0, 376°C, 1 hr] → oligonucleotide (pN)m → [RDase] → pN 2) 分離・定量a) カラムクロマトグラフィー・PC・TLC: 塩基とモノヌクレオチドを分離b) 濾紙電気泳動 (PC, TLC)
base: pH 1.8, 5000 mV, 300 mA, mononucleotide: pH 3.8, 5000 mV, 300 mA |
| 酵素 | ヌクレオチド10 A260単位当酵素量 | 緩衝液 | 反応時間/hr (37°C) | U-C-A-G-U-G-A-Cpの加水分化生成物 |
| リボヌクレアーゼT2 | 5活性単位 | 0.05M酢酸カリウム (pH 4.6) | 3 | 2Up + 2Cp + 2Ap + 2Gp |
| リボヌクレアーゼT1 | 5 μg | 0.05M Tris-Hcl緩衝液 (pH 7.5-7.8) or 0.05M TEAB (pH 8.0) | 12-18 | U-C-A-Gp + U-Gp + A-Cp |
| リボヌクレアーゼA | 10 μg | 同上 | 同上 | Up+Cp + A-G-Up + G-A-Cp |
| リボヌクレアーゼU2 | 0.05活性単位 | 0.05M 酢酸カリウム (pH 4.6) | 20 | U-C-A > p + G > p+U-G > p+A > p + Cp |
| ホスフォモノエステラーゼ | 0.15活性単位 | 0.05M TEAB (pH 8.0) or 0.05M 重炭酸アンモニウム | 3 | U-C-A-G-U-G-A-C+Pi |
| ヘビ毒ホスフォジエステラーゼ | 40 μg | 同上 | 5 | U + 2pC + 2pA + 2pG + pU |
| ヌクレアーゼP1 | 1 μg | 0.05M 酢酸カリウム (pH 5.3) | 1 | U + 2pC + 2pA + 2pG + pU + Pi |
| ポリヌクレオチドホスフォホリラーゼ | 150 μg | 0.1M リン酸カリウム (pH 7.0) & 0.01M 塩化マグネシウム | 2.5 | U-C-A, U-C-A-G, ppU, ppG, ppA, ppC' |
| ヌクレアーゼSW | 1.6 μg | 0.05M 炭酸ナトリウム (pH 10.5) & 0.1M 塩化ナトリウム & 0.5mM 酢酸マグネシウム | 1 | U-C, U-C-A, pU-G, pG-U-G, pG-A-Cp, pA-Cp, pCp, etc. |
[ クラーク数 | 単位 ]
微量元素液体試料ICP質量分析法 (ICP-MS, inductively coupled plasma mass spectrometry)
多元素に対し高感度
多元素同時分析可能(ICP-MSより感度劣る) |
原子吸光分析法 (AAS, atomic absorption spectrometry)
簡便 GG → 成分分離 → 質量分析 熱分解ガスクロマトグラフ質量分析法 (pyrolysis-GC/MS)GC/MSで測定できないポリマーや異物の分析 固体試料 (分解不要)蛍光X線分析法 (XRF, X-ray fluorescence analysis)中性子放射化分析法 (NAA, activation analysis) 加速器質量分析タンデム加速器質量分析/ accelerator mass spectrometry, TMAS 種子の年齢が測定できるらしい |
酸[塩基]水溶液に塩基[酸]水溶液を加える操作
pH値Case 1. 実験で使用される濃度の酸の水溶液a) 強酸(電離度1): 濃度 Ca (mol/l), 価数 A [H+] = Ca × A → pH = -log(Ca·A) b) 弱酸 HA (1価), 電離度 α (≪ 1)
電離定数 Ka = [H+][A-]/[AH] a) 強酸とその塩の水溶液 Ex. HCl + NaCl → 残っているHCl量でpH決まる(残っている酸の水溶液と考えればよい) b) 緩衝液 (緩衝溶液): 弱酸とその塩の水溶液 [弱塩基でも同様]Ex. CH3COOH + CH3COONa, 塩は100%電離しているとみなせる
[CH3COOH]は中和せずに残ったCH3COOHの濃度に等しい → Def. 緩衝作用: ある範囲の濃度では、その濃度に関わりなくpHは一定 溶液に酸・塩基を加えても、それらの物質量が弱酸[塩基]物質量より少なければpHは大きく変化しない Case 3. 塩: 水溶液中では100%電離しているとみなしてよいa) 強酸・強塩基 (Ex. NaCl, KCl, Na2SO4) → 中性 (b-d: 塩の加水分解起こる) b) 強酸と弱塩基 (Ex. NH4Cl, CuSO4)NH4Cl → NH4+ Cl- → NH3 + H+ + Cl- → 弱酸性 c) 弱酸と強塩基 (Ex. CH3COONa, NaHCO3, Na2SO4)
CH3COONa → CH3COO- + Na+ → Ka > Kb → 酸性, Ka = Kb → 中性, Ka < Kb → 塩基性 |
塩水溶液に酸を加える = 塩を構成する塩基に対する滴定
Ex. Na2CO3 + HCl: CO32- + H+ → HCO3-, HCO3- + H+ → H2CO3 塩水溶液に塩基を加える = 塩を構成する酸に対する滴定Ex. NH4Cl + NaOH: NH4+ + OH- → NH3 + H2O 滴定曲線中和滴定に伴う混合溶液のpH変化を示す曲線 → pH・濃度測定によく用いる濃度測定濃度既知の酸[塩基]水溶液 + 濃度未知の塩基[酸]水溶液 → 塩水溶液になった時点で未知濃度を得る酸: 価数 A, 水溶液濃度 Ca (mol/l), 体積va (ml) 塩基: 価数 B, 濃度 Cb (mol/l), 体積 vb (ml) → Ca/103 × A × va = Cb/103 × B × vb 方法
酸化還元滴定既知濃度の酸化剤[還元剤]を用い、未知濃度の還元剤[酸化剤]濃度を測定Ex 1. シュウ酸による過マンガン酸カリウム濃度測定
10.0 mlの1.00 mol/lシュウ酸水溶液をコニカルビーカにとる
酸性溶液中: IO3- + 5I- + 6H+ → 3I2 + 3H2O |
n: 媒質中の屈折率 物質中: 光速 ∝-1 屈折率 → 光学的距離等しければ光は進むのに同じ時間がかかる AB間の光学的距離 = dsに屈折率nをかけたndsに対するAからBまでの積分値 アデニン・ヌクレオチド (adenine nucleotide) 分離・同定サンプルを適当な倍率で希釈し210-360 nm吸収スペクトル測定
mol吸光係数: E1M1cm = 15.4·103 at 250 nm, pH = 7.0 サンプル 希釈率 1 2 3 4 5 Mean 4 × 400 0.415 0.35 0.395 0.39 7 × 1000 0.55 0.51 0.55 0.55 14 × 400 0.74 0.57 0.62 0.63 0.63 |
4: 26.5 (μg/ml)·400·100 = 1.06·103 (μg/ml) = 3.42·10-2 (mol/l)
4: 0.575 = AMP (0.24)
4: 0.73/(15.4 × 103) × 400 = 1.896 × 10-2 mol/l
4: (3.42 × 10-2)/(1.90 × 10-2) = 1.8 → クロマトグラフィによる測定 |
|
表. 膜による情報変換 - イオン・分子の検知
現象 センサー(例) 検出法 |
新しいイオン輸送 - センサーへの応用
能動輸送, 新しいキャリアの利用, 光による制御, 膜中電荷中性保存のための対イオン輸送 |
名詞
|
|
他動詞
栽培水耕法 water culture |
1. 液体培地→ 大量試料2. 寒天培地→ 寒天培地は表面でしか増殖しない
Case. 平板培地 |
滅菌不要なもの(一部の選択分離培地等): 寒天が完全に溶解するまで加温しシャーレで固めるものもある [ゼニゴケ培養] |
Laminaria遊走子培養1. 海藻培養a. 粗培養 crude cultureb. 単藻培養 single species culture: 生活史を知る時よく使用 c. 無菌培養 bacteria-free culture 2. 必要設備・器具解剖顕微鏡 dissecting microscope, 実体顕微鏡 stereomicroscope, 培養顕微鏡, キャピラリーピペット(capillary) pipette (CP), ゴム管(吸口付), 腰高シャーレ, 安全カミソリの刃, ペトリ皿, スライドグラス, ガーゼ, 小筆, 培養液, 培養庫(培養室), ピンセット, 濾紙, アルコールランプ, 冷蔵庫3. 胞子分離・培養
海産藻類一般用培地
Schreiber培地 a Foeyn培地
NaNO3 10 mg 10 mg
Na2HPO4·12H2O 2 mg 2 mg
海水 100 ml 100 ml
土壌浸出液 b 5 ml

ESP強化海水培地純粋1000 ml中(pHは7.8に調整)NaNO3 ___________________ 550 mg グリセロ燐酸ナトリウム _______ 50 mg Fe (as EDTA 1:1モルの割合) __ 2.5 mg 金属混液 PII _______________ 25 ml ビタミン B12 ________________ 10 g チアミン HCl _______________ 0.5 mg ビオチン __________________ 5 g トリスアミノメタン ____________ 500 mg |
海藻類に有効な人工合成培地(純粋100 ml)
ASP1 ASP2 ASP6 ASP7 ASP12
(NTA) (NTA)
NaCl 2.4g 1.8g 2.4g 2.5g 2.8g MgSO4·7H2O 0.6g 0.5g 0.8g 0.9g 0.7g MgCl2·H2O 0.45g - - - 0.4g KCl 0.06g 0.06g 0.07g 0.07g 0.07g Ca (as Cl-) 40mg 10mg 15 mg 30mg 40mg NaNO3 10mg 5mg 30mg 5mg 10mg K2HPO4 2mg 0.5mg - - - K3PO4 - - - - 1mg Na2SiO3·9H2O 2.5mg 15mg 7mg 7mg 15 mg NaCO3·H2O - 3mg - - - グリセロ燐酸Na - - 10mg 2mg 1mg Fe (as Cl-) - 50μg - - - 金属混液PIIa 1ml 3ml - 3 ml 1ml 金属混液SIIb - - - - 1ml 金属混液P8c - - 1ml - - ビタミンB12 (μg) 0.02 0.2 0.05 0.1 0.02 ビオチン - - - - 0.1μg チアミンHCl - - - - 10μg ビタミン混液S3d - 1ml - 1mg - ビタミン混液8Ae 0.05ml - 0.1ml - - ニトリロ3酢酸 - (10mg) - 7mg (10mg) トリスアミノメタン 0.1g 0.1g 0.1g 0.1g 0.1g pH 7.6 7.8 7.6 7.8-8.0 7.8-8.0 a. 金属混液PII - 1 mg中: Na2EDTA 1 mg, Fe (as Cl) 0.01 mg, B (as H3BO3) 0.2 mg, Mn (as Cl or SO4) 0.04 mg, Zn (as Cl or SO4) 0.005 mg, Co (as Cl or SO4) 0.001 mg. b. 金属混液SII - 1 ml中: Br (as Na) 1 mg, Sr (as Cl) 0.2 mg, Rb (as Cl) 0.001 mg, Li (as Cl) 0.02 mg, Mo (as Na) 0.05 mg, I (as K) 0.001 mg. c. 金属混液P8 - 1 mg中: Na3HEDTA 3 mg, Fe (as Cl) 0.2 mg, B (as H3BO3) 0.2 mg, Mn (as Cl) 0.1 mg, Zn (as Cl) 0.05 mg, Co (as Cl) 0.001 mg, Mo (as Na) 0.05 mg, Cu (as Cl) 0.002 mg. d. ビタミン混液S3 - 1 ml中: チアミンHCl 0.05 mg, ニコチン酸 0.01 mg, バントテン酸カルシウム0.01 mg, p-アミノ安息香酸1 μg, ビオチン 0.1 μg, イノシトール 0.5 mg, 葉酸 0.2 μg, チミン 0.3 mg. e. ビタミン混液8A - 1 ml中: チアミンHCl 0.2 mg, ニコチン酸0.1 mg, プトレスシン2HCl 0.04 mg, パントテン酸カルシウム0.1 mg, リポフラビン5 μg, ピリドキシン2HCl 0.04 mg, ピリドキサミン2HCl 0.02 mg, p-アミノ安息香酸0.01 mg, ビオチン0.5 μg, クエン酸コリン0.5 mg, イノシトール 1 mg, チミン0.8 mg, オロチン酸 0.26 mg, B12 0.05 μg, ホリニン酸 0.2 μg, 葉酸 2.5 μg. |
|
合州国(The United States of America)での調査で分からないと悲惨なので、ここに置いておこう。もっとも、向こうでもインチ尺を調査に持ってきて、ガックりしてるシーンも見たけど。 Def. 真の値(真値) real value: ある物理量に1つだけ存在する値
測定と見積り: 測定器用い物理量測定 → 測定器指度 ≠ 被測定量 Def. 単位: 量を数値で表すための基準となる約束された一定量 → 実証的性格(現象を人に見せる)
連続量 → 誤差 |
次元解析 dimensional analysis (unit analysis)物理量各次元(長さ・質量・時間・電荷等) → 他物理量次元との関係や未知の物理量の次元を解析、予測次元 (記号は仮): L = 長さ, M = 質量, T = 時間 Ex. ばねにつないだ物体の振動運動
m [次元M] 水平面上に置いた物体の質量. k, ばね定数[MT-2] T = A√(m/k) [Aは無次元量の定数で次元解析から求められない] → 解は運動方程式を解いて求めたものと一致 → 簡単な問題は次元を考えるだけで見通しが立つ式の次元が合うことは必須 → 式の間違いをチェックする場合も使える |
単位換算 (unit conversion): 病院では、体温は華氏、体重はポンド、薬の量は ...
温度華氏 (Fahrenheit, °F) vs 摂氏 (Celsius, °C)厄介だが、ワシントン大学では、常に、°Fと°Cの両方が恒温器に大きく張紙してあった。留学生が増え、こうするしかないんだろうとは思うが(日本もそうなるのか)。 容積 (gallon)1 liter (l) = 3.785411784 gallon (gal) |
1 gal = 4 quarts = 8 pints
質量(重さ) (pound)1 pound (lb) = 453.59237 grams (g)1 (short) quarter (= 1/4 hundredweight) = 25 lb 16 oz = 1 lb → 1 ounce (oz) = 1/16 lb 長さ (foot, feet / mile)1 foot (ft, ′) = 0.3048 (1200/3937) m1 in (", inch) ≈ 2.54 cm 1 ft = 12 inches |
1 yard (yd) = 3 feet ≈ 91.44 cm 1 mile (mi) = 1.609344 km 1 mi = 1760 yd 面積 (acre)面積・体積は、単位も違うが、スクエアーなんとかとかキュービックなんとかとなるとお手上げ1 acre (ac) = 4046.856 m² or 4046.872 m² 1 square mile = 640 ac 1/4·1/4 square mile = 40 ac |
|
日本の古い単位くらいは、記憶にあってもいいかも - 尺貫法もヤードポンド法も時代や地域によって異なることがある 尺貫法 Japanese measuring system1貫 = 100両 = 1000匁 = 10000分 = 100000厘 = 3750 g1斤 = 16/100貫 = 600 g 1里 (≈ 3927.27 m) = 36町 = 36 × 60 間 = 36 × 60 × 60 尺
1間(歩) = 6尺 (1尺 = 10/33 m ≈ 30.3 cm = 10寸) = 181.8 cm
サブロク = 3尺 × 6尺 = 900 mm × 1818 mm 1畝 = 30坪 (1坪 ≈ 400/121 m2 ≈ 3.3 m2) = 30 × 10合 = 100勺 匁は真珠の質量単位として現在に残る 1石 = 10斗 = 100升 = 1000合 (1合 = 180.39 ml) |
ヤードポンド法grain (gr) グレーン = 0.0647989 g (7,000 gr = 1 lb)dram (dr) ドラム = 1.7718437 g (16 dr = 1 oz) ounce (oz) オンス = 28.3495 g (16 oz = 1 lb) - 常衡 avoirdupois pound (lb) ポンド = 453.59237 g (2,000 lb =1 t [米]) short ton [米] トン = 907,184 g long ton [英] トン = 1,016,046 g その他troy ounce (oz) トロイオンス = 31.1035 g (12 oz = 1 lb) - 金衡(troy)金貨質量 (英国では金、銀、宝石質量単位) troy pound (lb) トロイポンド = 373.242 gcarat (ct) カラット = 0.2 g ダイアモンドはcarat、金はkarat |
|
= 基本単位 fundamental unit 物理量の大きさを世界共通単位系で表す → 国際(学術・教育)交流 + 産業・社会生活上の利便大
→ 単位系国際的統一: 標準単位 standard unit = SI単位系  国際単位系: 国際度量衡総会 (Conference Generale des Poids et Mesures/CGPM, メートル条約最高決議機関) 採択可決 → 日本1974.4導入
国際単位系: 国際度量衡総会 (Conference Generale des Poids et Mesures/CGPM, メートル条約最高決議機関) 採択可決 → 日本1974.4導入単位の定義と具体的に表す標準: 科学技術進歩に伴い最高精度が必要 → 高精度標準を研究 量 (単位記号): 目的と利便さを考慮し選定 → 次元的に独立と見なされる7量
|
SI補助単位(国際単位系補助単位)2単位ある。基本単位を用い組立単位を作る際に使用量: 単位名称 (単位記号)
|
|
7基本単位から換算係数(変換係数) conversion factors含まない乗除算で導き出せる単位 Ex. km/h 固有名称持つSI組立単位: 固有名称と記号が与えられ、基本単位から出発し表現するよりも便利 量, 単位名称 (単位記号, 他SI単位表現, SI基本単位表現) 周波数, hertz (Hz, -, s-1) 力, newton (N, -, mkgs-2) 圧力, pascal (Pa, Nm-2, m-1kgs-2) |
エネルギー, joule (J, Nm, m2kgs-2) 仕事率(工率), watt (W, Js-1, m2kgs-3) セルシウス温度, 摂氏 (°C, K, K) 電気量(電荷, coulomb (C, As, As) 電圧, volt (V, WA-1, m2kgs-3A-1 静電容量, farad (F, CV-1, m-2kg-1s4A2) 電気抵抗, ohm (Ω, VA-1, m2kgs-3A-2) コンダクタンス, siemens (S, AV-1, m-2kg-1s3A2 |
磁束, ウェーバ (Wb, Vs, m2kgs-2A-1) 磁束密度, テスラ (T, Wbm-2, kgs-2A-1) インダクタンス, henry (H, WbA-1, m2kgs-2A-2) 光束, ルーメン (lm, cdsr, cd) 照度, lux (lx, lmm-2, m-2cd) 放射能, becquerel (Bq, s-1, s-1) 吸収線量, グレイ (Gy, Jkg-1, m2s-2 線量当量, シーベルト (Sv, Jkg-1, m2s-2) |
| 量 | 単位記号 | 量 | 単位記号 | 量 | 単位記号 | 量 | 単位記号 |
|---|---|---|---|---|---|---|---|
| 面積 | m2 | 体積 | m3 | 密度 | kgm-3 | ||
| 速さ | ms-1 | 加速度 | ms-2 | 波数 | m-1 | ||
| 電界強度 | Vm-1 | 磁界強度 | Am-1 | 電気変位 | Cm-2 | 誘電率 | Fm-1 |
| 透磁率 | Hm-1 | ||||||
| エントロピー | JK-1 | 比熱容量, c | Jkg-1K-1 | 熱フラックス密度, q | Wm-2 | 熱伝導度, l | Wm-1K-1 |
| 物質量濃度 | molm-3 | モルエネルギー | Jmol-1 | 比潜熱, l | Jkg-1 | ||
| 輝度 | cdm-2 | 粘度 | Pas | 表面張力 | Nm-1 |
非SI単位 (SI以外の単位)幾つかの単位系があり、定数や式の形が異なるEx. f = ma = m·dv/dt = m·d²x/dt² = dP/dt
基本単位系/定義
長さ L
時間 T
質量 M
電流 |
英国熱量単位 British Thermal Unit, BTU (Btu), 1 Btu = 1.055 kJ
動力単位系(工学系で使われる)基本単位 L, T, F(力)、組立単位 [質量] = [FL-1T-2]
g = 9.80665 m/sec²: 1 kgの質量に働く重力 = 1 kg重 = 9.80665 N |