(2020年12月14日更新) [ 日本語 | English ]
HOME > 講義・実習・演習一覧 / 研究概要 > 小辞典 > 化学 > 化学物質
|
[ 原子 ] 炭素 carbon (C)木炭 carbo (Latin)原子番号 6 前史以前: 不完全燃焼で発生 + ダイアモンドは稀少硬石(中世以降: カッティング技法開発され装飾品化) 非金属元素。単体・化合物両方で多様な形状 > 1000万種の化合物
Ex. 有機物 = 生物構成材料(光合成・呼吸等、生命活動全般で重要) 炭素原子同位体3種: 12C (主要, 存在比 98.9%), 13C (微量, 1.1%), 14C (極微量)
12C: IUPAC (1961) 質量基準に決定 - 基礎定数算出基準(Ex. アボガドロ数)
大気CH4のδ13C, δDはCH4収支を考えるのに有用 化学 (chemistry)= 有機化学 + 無機化学 |
有機化学 organic chemistry有機化合物 = 生物体構成分であり、生命力なしで作れない物質と考えた1828 Wöhler F (1800-1882, 独) 尿素(有機化合物) = シアン酸アンモニウム水溶液加熱で無機的合成 1845 Kolbe AWH (1818-1884, 独: Wöhlerの弟子)
酢酸を無機的合生 – 合成経路説明
炭酸(無機化合物)アミド体尿素が有機化合物になる等、有機化合物と無機化合物の境界は曖昧 無機化学 inorganic chemistry原子、イオン ion (陰イオン anion, 陽イオン cation)、分子、固体結晶、溶液、錯体 – 無機化学的諸性質無機化合物の持つ物理的化学的性質の解明 → 周期律や物性値等に基く元素性質の系統的まとめ |
[ 原子構造 ]
|
物質量 (mole or molar number): 過去には「モル数」と訳す Def. アボガドロ数 Avogadro constant, NA or L: 6.02214076 × 1023 ≡ 物質量1 molを構成する粒子の個数 ⇔ Def. 原子量 atomic weight, M: アボガドロ数あたりの質量12C = 12 (基準) → 他原子はCに対する比で表す Ex. H = 1, He = 2, O ≈ 16 Def. グラム原子量 gram atomic weight= 原子質量単位 atomic mass unit, u: 原子量にグラムの単位をつける Ex. 酸素1グラム原子 = 15.9994 g ≡ Oがca 6 × 1028個の質量 Def. 分子量 molecular weight: 分子中の原子の原子量の総和
H2O = 1 × 2 + 16 = 18 = 分子量にグラムをつけたもの 1モル(mol)は化学の単位 Def. 1 mol = アボガドロ数(6.02 × 1023)個の分子の集まり
Ex. Al = 27 (1円硬貨は1 g → 27個の1円硬貨で1 mol)
2. 40/22.4 (mol) CH4 + 2O2 → CO2 + 2H2O → H2Oは倍の3.57 mol
3. 40/22.4 = 1.79 mol
水: 密度は水圧に依存しない。温度で変化する Def. 1グラム当量(g当量) gram equivalent: 1当量にgつける → 質量比
= (イオン1 mol)/(イオン価) or (原子1 mol)/(原子価)
Def. モル当量: 物質量比 Q (原子量と密度) ある金属の密度10.5g/cm3、体積 6.84 × 10-23 cm3の立方体中に4原子を含む → 原子量M A 10.5 ×(6.84 × 10-23) = 7.182 × 10-22 (g) → 4原子 ∴ M = 1.7955 × 10-22 × 6.0 × 1023 = 107.73 |
原子量決定法
A. Dulong-Petitの法則 → 25/0.71 = 35.2 (誤差大 → 注意) Cl: 1価, 当量(35.45) = 原子量 = 35.45 → 35.45 × (100 – 63.977)/63.977 = 19.96 → 19.96 × 2 = 39.92 Law. 質量保存の法則 law of conseveration of mass (Lavoisier)化学反応前後で全質量は増減しない Law. 定比例の法則 (Proust, J.L. 1754-1826)同一化合物 → 成分元素質量比一定(生成条件・経路無関係) Law. 倍数比例の法則の説明に原子説提唱(1803) → 化学に適用するよう修正 → 原子の特徴は"質量" (Dalton 1808)
1-3: ダルトンの原子説 1808 倍数比例の法則(定比例の法則)をDalton自身が実証A, B: 元素 → 質量比 = MA:MB, 各元素の原子1個の質量 = mA, mB (g/個), 個数nA1, nB1 (整数)
化合物1 MA1:MB1 = nA1mA:nB1mB → 1:nB1mB/ nA1mA = nB1nA2:nB2nA1 → 自然数比 Law. アボガドロの法則 Avogadro's law (or principle), 1811
░░|░░ + ██ = ▓▓|▓▓
1グラム分子に含まれる分子数, NA = 6.0221415 × 1023 mol-1 正確なアボガドロ数測定の始まり |
|
原子の結びつき方: 価電子 = 0~7 (8 = 0)
電子対(2個ずつの電子)にし考える
非結合物質 (= 単原子分子monoatomic molecule): 原子が単に集合 2原子分子 diatomic molecule, …, n原子分子
共有結合性物質(= 分子性物質): 共有結合で作られる分子
→ 高分子物質: 共有結合物質が集合 Ex. デンプン starch ファン・デル・ワールス力 van der Waals forces (分子間力, s.s.)
分子内で生じた電荷の偏りが近くの他分子の電荷の偏りを誘発 → 引力発生 S = 表面積 (surface area), V = 体積, ρ = 密度 [イオン結合 = とってとられて8 ⇔ 共有結合 = 互いに出し合い8] 代表的1) 共有結合 covalent bind: 原子間結合に価電子を原子間で共有し、原子1個につき見かけ上、価電子8個になる(水素は2個)
原子価と価標: 他の原子との間で電子対を作れる数
Ex. 炭素原子の混成オービタル
C s px py pz Ex.
sp3 • • • • CH4
sp2 • • • π CH2=CH2
sp • • π π CH≡CH, O=C=O
n重結合: 組手数 ≡C-C≡: 一重結合 =C=C=: 二重結合 -C≡C-: 三重結合
分極 polarization
極性分子 polar molecule: 極性残る分子
多原子イオン Ex. NH4+, SO42-, H3O+
金属元素と非金属元素からできているもの多 |
イオン化エネルギー ionization energy: 気体状態の原子から電子を1個取り去る時に必要なエネルギー 安定な電子配置の原子から電子を取り去る → エネルギー大 ⇔ 電子親和力: 気体状態の原子が1電子を獲得した時に放出するエネルギー電気陰性度: 化合物中のある原子の電子を引く能力を比較する数値
陽性元素: 価電子失い陽イオン化し易い元素 Ex. Li, Na, K, Mg, Ca ⇔ 融点高く、延性・展性大。電気伝導性、熱伝導性大 Ex. Al, Cu
原子配列: ⇒ 結晶
自由電子のイメージ:
Ex. アンモニウムイオン NH4+ ⇒
Ex. H3N: + Ag+ + :NH3 → [Ag(NH3)2]+ 分子
Ex. 酢酸 acetic acid 物質を原子記号(化学記号chemical symbol)と数字で表す Ex. H2O Def. 示性式 rational formula分子中グループとみなした方が理解しやすい原子団を表現基本 Def. 組成式(実験式) empirical formula: 分子の原子種類とその数の最小比
Def. 式量 formula weight: 式中の各原子の原子量の総和 (≈ 分子量) Ex. C (ダイヤモンド), SiO2 (二酸化珪素), H2SiO3 (珪酸) Def. 構造式 structural formula: 分子を作る原子の結合様式を表現Def. 電子式: 各原子の価電子及び共有電子対の様子を表現 [化学平衡] |
|
= 有機物以外の物質 単体: 一種類の元素からなる + 化合物
酸化物: 酸性酸化物 + 塩基性酸化物 + 両性酸化物 解離 dissociation1分子が成分原子かより小分子(中性 neutralまたはイオン)に分解し、その変化が可逆的な分解電離 ionization原子・分子がイオン(電子を失うか、過剰電子を得て電荷を帯びた原子や分子)になること1) 純物質: 特徴 → 定圧(常圧) → 沸点・融点・密度・化学的性質一定 Ex. 臭素 bromine, 35Br: Balard AJ (1826)発見。ハロゲン元素 常温・常圧で暗赤色液体 (mp = -7.3°C, bp = 58.8°C)。反応性塩素より弱。刺激臭・猛毒。海水中微量 2) 混合物 mixture = 溶体 solution (s.l.)
混合気体 均一な混合物 homogeneous mixture ↔ 不均一な混合物(不均質な混合物) heterogeneous mixture 混合度 (degree of mixing)1) 濃度 concentration, C単位容積あたり溶液中の溶質の量 mol·dm-32) 重量パーセント weight (mass) percent, %単位質量の100倍溶液中の溶質質量。単位無 dimensionless
ppm, ppb: 残留農薬や食品添加物量で良く使う濃度(割合)単位 |
3)モル濃度a) 容積(容量)モル濃度(mol/l) molar concentration or molarity, m' (M): 単位容積あたり溶媒中の溶質量= 1 l中の溶質の質量/分子量 b) 重量モル濃度 (mol/kg) molarity, m: 単位質量当り溶媒中溶質量 = 溶媒(水1 l)に溶質1 molを溶かした濃度
Ex. x gの溶質を溶かす 4)モル分率 mole fraction, XA成分Aの量を全成分の全量で割ったもの
システム system → a: na mol, b: nb mol, c: nc mol, …, ni mol 5)規定度 normality, N溶液/dm3中に含まれる溶質のg当量数m規定(= m mol/l), v ml → mv/1000 mol (≡ g当量) Ex. 1 N HCl 500 ㎖作る – 溶液1 ℓを考えるA.__HCl mw = 36.46, 35% (specific gravity 1.18-1.19) of w/w, w/v, v/v HCl 35%溶液質量 = 1.18 × 1000 g その中のHCl質量 = 1.18 × 1000 × 35/100 HCl 35%溶液は(1.18 × 1000 × 35/100)/36.46 = 11.3 N → これから1N HClを500 ㎖作る
11.3:1 = 500:x, 11.3x = 500 × 1 Q. NaOH 25.8 g (mw = 40) + H2O 100 g → 比重1.23水溶液 ⇒ モル濃度 A. v = (100 + 25.8)/1.23, NaOH = 25.8/40 mol → (1.23 × 1000 × (25.8/125.8))/40 = 6.31 (mol/l) |
エーテル (ether)反応性乏しい(蒸気は可燃性)ジエチルエーテル: b.p. 34.48°C、揮発性・引火性高 → 有機溶剤、麻酔剤 アルコール (alcohol)CnH2n+1OHn価アルコール: n = 1分子中に-OHのある数 アルコールの融点(m.p., °C)、沸点(b.p., °C)、溶解度(g/100 g) 一価 CH3OH (メタノール): -98, 65, ∞ C2H5OH (エタノール): -115, 78, ∞ CH3CH2CH2OH (1-プロパノール): -127, 97, ∞ CH3CH(OH)CH3 (2-プロパノール): -90, 82, ∞ CH3CH2CH2CH2OH (1-ブタノール): -90, 117, 8.0 CH3CH2CH2CH2CH2OH (1-ペンタノール): -, 138, 2.2 二価 CH2(OH)CH2(OH) (1,2-エタンジオール/エチレングリコール): -13, 198, ∞ 三価 CH2(OH)CH(OH)CH2(OH) (1,2,3-プロパントリオール/グリセリン): 18, -, ∞ アルコールの構造による分類 (名称 一般式, 例)
第1級アルコール R1-CH2-OH, CH3OH 1) 微生物法(アルコール発酵): C6H12O6 → 2CH3CH2OH + 2CO2 2) 水生ガスから合成(+ ZnO, CrO3 = catalysis, 350-400°C, 150-200 atm) CO + 2H2 → CH3OH (メタノール 8-20 g摂取で失明、致死量30-50 g) 3) ジアゾニウム塩分解R-NH2 + HNO2 → [R-N2]+ → R-OH + N2 水酸基(-OH) → 極性あり → 水酸基間で水素結合可能
(結合エネルギー = 12.6-20.9 kJ/mol)
第1級アルコール: R-CH2-OH → R-CHO [アルデヒド] → R-COOH [カルボン酸] フェノール(石炭酸, phenol or benzenol, ArOH)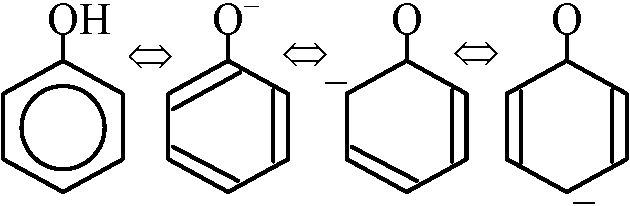 s.l. 芳香環(特にフェニル基R部分)に水酸基が結合した化合物
s.l. 芳香環(特にフェニル基R部分)に水酸基が結合した化合物s.s. 石炭酸 C6H5OH 共鳴構造 安定化するため弱酸として働く (Ka = 10·10-10) アルデヒド・ケトン aldehyde/ketoneアルデヒド 融点 沸点 (比重)HCHO (ホルムアルデヒド, formaldehyde) -92 -20 (0.815) CH3CHO (アセトアルデヒド) -123.5 20 (0.781) CH3CH2CHO (プロピオンアルデヒド) -81 49 (0.807) C6H5-CHO (ベンズアルデヒド) -26 179 (1.046) ケトン 融点 沸点 (比重) CH3COCH3 (アセトン) -94 56 (0.791) CH3COC2H5 (エチルメチルケトン) -86 80 (0.805) C2H5COC2H5 (ジエチルケトン) -42 102 (0.814) ホルマリン: ホルムアルデヒド40%水溶液 カルボニル基 →合成法
|
反応
カルボン酸 carboxylic acid表. 芳香族カルボン酸 (構造 名称 m.p., b.p. (解離定数)
C6H5COOH 安息香酸 122, 249.2 (6.4 × 10-5), 防腐剤・染料原料
アクリル酸 CH2=CHCOOH 会合 (association)見かけより分子量大きくなる → 沸点、融点が分子量の割に大きい 低分子では水によく溶ける。高分子はミセルコロイド形成するものもある 反応
エステル ester酢酸エチル CH3COOC2H5: m.p. –83.6°C, b.p. 77.2°Cサリチル酸メチル C6H4(OH)COOH 芳香、消炎、鎮痛 アセチルサリチル酸(アスピリン) C6H4(OCOCH3)COOH:解熱(バファリン主成分) 加水分解CH2COOC2H5 + H2O → CH2COOH + C2H5OH鹸化CH2COOC2H5 + KOH → CH2COOK + C2H5OH石鹸(R-COONa, ミセル化) Ex. C11H23COONa ラウリル酸ナトリウム
-ONa: 親水性 vs. CnHn+1: 親油性 → このバランスで水にも油にも溶ける
親水基 -OSO3Na 硫酸エステルナトリウム, -SO3Na スルホン酸ナトリウム, -OH
(a) H2SO4 → R-CH2OSO3Na, (b) Alkaline → R-CH2OSO3Na |
|
空間電荷 space charge: 電子やイオンの移動により電荷が蓄積する状態 Ex. HCl + NaOH → NaCl + H2O
→ [反応部分] H+ + OH- → H2O [ pH ] Def. (Arrhenius 1887)酸: 水素を持ち、水溶液中で電離しH+を放つ物質 Ex. HCl → H+ + Cl-, H2SO4 → H+ + HSO4- 塩基: 水溶液中で電離しOH-を放つ物質
Ex. NaOH → Na+ + OH-, Ca(OH)2 → Ca2+ + 2OH- 酸 (陽子供与体): プロトン(陽子H+)を他に与える分子・原子およびイオン 塩基 (陽子受容体): 陽子H+を他から受け取る分子・原子およびイオン Q. H2SO4, HSO4-, SO42-を酸、塩基に分類せよ A.酸、酸かつ塩基、塩基 Def. (レビス Lewis) 酸: 電子対を与えるもの → 酸と塩基の共益関係: 酸 ↔ H+ + 塩基
酸HA水溶液で成立する平衡状態 → HA ↔ H+ + A- 電離平衡・電離度非電解質 nonelectlytes1. 拡散 diffusion
溶質及び水の移動は分子量の影響を受け、溶質濃度勾配に反比例し移動距離に逆比例 → 細胞間及び内の移動は急速だが、m単位の距離になると遅い 電解質 electlytes
電解質移動には膜のイオンチャージおよび水和性を考慮 = (a × 6.02·1023個)/(C × 6.02·1023個) 表. 電離度(α)による酸・塩基の分類
電離度 α ≈ 1 α << 1
分類 強酸 強塩基 弱酸 弱塩基
Ex HCl, H2SO4 NaOH, Ca(OH)2 H2CO3 NH3, Fe(OH)2
Ex. 硫酸の電離 H2SO4 ↔ HSO4- + H+ ↔ SO42- + 2H+ 強酸 = 完全に電離: HA + H2O → A- + H3O+ [オキソニウムイオン]弱酸 = 平衡関係: HA + H2O ⇄ A- + H3O+ ⇒ HA ⇄ H+ + A- Law. 質量作用の法則 (化学平衡の法則) 電離定数 Ka = [A-][H+]/[HA] → 強酸 Ka > 弱酸 Ka [塩基でも同様] Ex. CH3COOH ↔ CH3COO- + H+ ↔ KCH3COOH = [CH3COO-][H+]/[CH3COOH] この状態に酸HAを加える → KHA = [A-][H+]/[HA]H+の価は共通 → KCH3COOH /KHA = ([CH3COO-]/[CH3COOH])/([A-][HA]) Def. 価数: 酸・塩基が完全電離した時の水素イオンの物質量値(H+の係数)価 酸 塩基 1 HCl, HNO3, CH3COOH, HI NaOH, KOH, NH3 2 H2SO4, H2SO3, H2CO3 Ca(OH)2, Cu(OH)2, Ba(OH)2, Fe(OH)2 3 H3PO4 Al(OH)3, Fe(OH)3Def. 中和反応: 酸(H+)-塩基(OH-)間でH+が受け渡される化学反応 Ex. 二価の酸水溶液 H2A ↔ HA- + H+ ↔ 2H+ + A2- (Eq. 1)
塩基加える[ルシャトリエの原理により平衡移動] 酸の価数 A, 水溶液濃度Ca (mol/l), 体積va (ml) → 塩基が受け取れるH+物質量(mol) ≡ Cb/103 × B × vb → 中和反応における酸HAと塩基BOHの間で生じるH+の授受を表す反応式HA + BOH → BA + H2O Def. 塩 ≡ BA: 酸の陰イオンと塩基の陽イオンからなるイオン結晶 Ca/103 × A × va = Cb/103 × B × vb Ex. 1. HCl + NaOH → NaCl + H2O → H2Oを蒸発させNaClを得るEx. 2. CH3COOH + NaOH → CH3COONa + H2O CH3COOHは弱酸 = 平衡状態存在 → CH3COO- + Na+ + H2O ↔ CH3COOH + Na+ + OH- → H2Oを蒸発させるとCH3COONaを得る 塩の分類1) イオン Ex. ナトリウム塩(Na+), 炭酸塩(CO2-) → Na2CO32) 反応性 正塩: 水素イオンになるHも水酸化物イオンになるOHも持たない塩 Ex. NaCl, CuSO4, CH3COONa 酸性塩: 水素イオンになるHを持つ塩
NaHCO3 → Na+ + HCO3- (NaHCO3 + NaOH → Na2CO3 + H2O) 塩基性塩: 水酸化物イオンになるOHを持つ塩 CuSO4·3Cu(OH)2
→ 4Cu2+ + SO42- + 6OH- (CuSO4·3Cu(OH)2 + 3H2SO4 酸化物の分類酸性酸化物: 水に溶けて酸性を示すか、塩基と反応し塩を生成する
非金属酸化物
金属酸化物 Ex. CaO, Fe2O3,
両性元素酸化物 Ex. Al2O3, ZnO, SnO, PbO, → 2Na[Al(OH4)]テトラヒドロキソアルミン酸ナトリウム = 錯酸 Def. 酸化: 電子を失うこと1. 電子脱離
イオン数変化: Fe2+ → Fe3+ + e-, Cu+ → Cu2+ + e-
硫酸酸性溶液中 MnO4- + 8H+ + 5e- → Mn2+ + 4H2O
OH- CO + 1/2O2 → CO2 (Oxygenase), or H2O + 1/2O2 → H2O2 Def. 還元: 電子を得ること = 還元反応は全て酸化の逆反応
還元剤 reducing agent or reductant: 相手に電子を与える物質 |
酸化還元反応 (redox reaction)化学反応中、酸化・還元が同時に起こる反応Ex. Fe2O3 + 3CO → 2Fe + 3CO2 [Fe3+がFeに変化] 酸化数H2 + I2 → 2HI → イオンが含まれない反応 → 酸化数という概念導入し酸化還元考える
NaCl → Na+ + Cl- [Na+ = 酸化数+1, Cl- = 酸化数-1]
Ex. 過マンガン酸カリウム(potassium permanganate, KMnO4 Ex. トリフェニルテトラゾリウムクロライド (TTC): 種子生死判別に利用 テトラゾリウム(tetrazolium)塩類: 酸化状態では可溶性で無色、還元状態では不溶で強く着色されるためdehydrogenaseおよびdiaphoraseの組織化学的研究で重要な物質。Tetrazolium誘導体とdittetrazolium誘導体が用いられ、tetrazolium誘導体は一般に赤色のformazanとなる。Ditetrazolium誘導体は二つの反応生成物をつくる。一つは一般に赤色のmonoformazanで、他の一つは青色あるいは赤紫色のdiformazanである Table. Tetrazolium塩類の特性 (鋭敏度は1-4の方に増加。*: コバルト存在下) 略記号 TT INT NT TB NN NTB MTT* 鋭敏度 1 3 3 2 4 4 4 色彩 赤 赤紫 赤紫 赤・蒼 赤紫 青 黒 O2に対する安定性 0 0 + + 0 0 0 脂質に対する溶解性 有 有 有 有 ± 無 無 沈殿の大きさ 極大 大 種々 種々 細 細 細 Table. Tetrazolium塩類と反応する主な還元性物質と還元系
I群: 酵素
還元性物質あるいは還元系 プレパラート 実験条件
Endogeneous reductase 凍結・固定しな pH 6-7
い無傷細胞
Dehydrogenase 固定しない組織 特異的基質存在
and diaphorase の凍結切片
II群: 酵素ではない物質
-SH基 固定組織切片 pH 9-11
還元性炭水化物 固定組織切片 pH 11
Lipofuscin 固定組織切片 0.1 Nアルカリ存在
Kultchisky細胞 固定組織切片 0.1 Nアルカリ存在
およびadrenochrome
酵素は固定されていないプレパラートで近中性tetrazolium溶液を用いる 半反応式: 還元・酸化剤の電子授受関係のみ示す (⊂ 化学反応式)
O2 + 4e- → 2O2- [pH] イオン化傾向(イオン化列・電荷列) ionization tendency: 酸化・還元剤強弱に関連K Ca Na Mg Al Zn Fe Ni Sn Pb (H) Cu Hg Ag Pt Au イオン: なりやすく電子出しやすい__←___→__なりにくく出しにくい (応用: ボルタの電池)空気中酸化:__ 速やか ←_____________ → されない 水:________常温反応 ←______________→ 反応しない 酸:____希酸水素発生 ←______________→ 王水に溶ける Def. (標準)酸化還元電位 oxidation reduction potential: 酸化物質・還元物質平衡で生ずる電位と基準電位の差 → 反応により一定 [単位 mV or V]
酸化還元電位: E, Eh
陽極 = 酸化反応 ⇔ 陰極 = 還元反応
⊕ K+, Ca2+, Na+, Mg2+, Al3+, H+ → H2↑
Def. 電解槽 (electrolyte) cell: 電解に用いる槽 Def. 電気化学当量 electrochemical equivalent (単位, F ファラデー): 式で1モル当量の酸化(還元)反応を引き起こす電子の移動量を電荷量で表した
電極反応 = 酸化還元反応 ⇒ 電荷移動量 ∝ 酸化還元反応量 第一法則: 陽極⊕陰極⊖で生成する物質量 ∝ 通過した電気量 第二法則: 1g当量の物質を生成する電気量 = (物質種類に関係なく)一定 ⇒ 第一法則 × 第二法則: 電解による両極の析出量 (g)
= (通過したファラデー数) × (1 g当量) A._ (1) ファラデー数 = (100A × (60 × 60sec))/(9.65 × 104) = 3.731
Cu 1 g当量 = 63.526/2 = 31.773 (g)
(2) OH- - e- → 1/2·H2O + 1/4O2 ∴ 1/4 mol O2 = 1 g当量
32/4 g O2 → 22.4/4 = 5.6 l 白金電極(⊕ 陽極, ⊖ 陰極) Ex. 塩化銅(II)水溶液
CuCl2 → Cu2+ + 2Cl- (電離度大) 応用: メッキ(鍍金)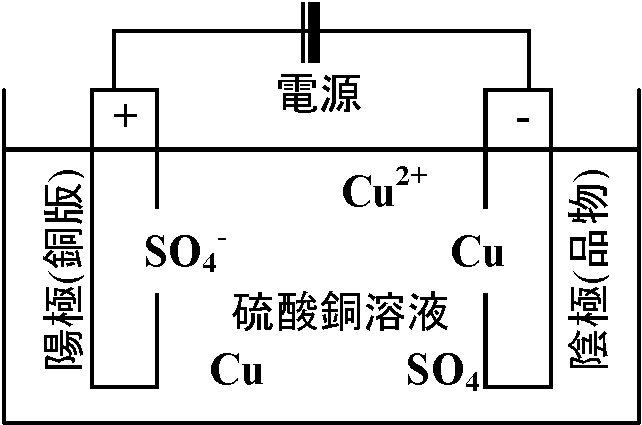 電気メッキ electroplating: 電解液中 →
電気メッキ electroplating: 電解液中 →
⊖ メッキされる金属製品 ⇔ ⊕ 付着させたい金属
Ex. 鉄板 + 被覆金属(亜鉛合金 = トタン) 真空中で、メッキに使用する金属を加熱蒸発させ、品物表面に凝集させる → 非金属にもメッキ可能 |
構造 → 性質 = 基本骨格(C, O等)の性質 + 官能基の性質基本骨格CxHyOz ⇒ 分子量, M = 12x + 1y + 16z脂肪族炭化水素 aliphatic hydrocarbon
アルカン alkane (パラフィン系炭化水素) ≡C-C≡___sp3混成 |
官能基 functional groupEx. -OH, -C=C-, -C≡C-, -CHO, -NH2残基 resihne: functional groupに属さぬ部分 Ex. alkyl (R), aromatic (Ar, aryl) 同族列 homologous series
CH3OH, C2H5OH → alcohol |
| 化合物名称 | 基名称 | 基 | 例 |
| 肪族炭化水素 | アルキル基 | 炭化水素 CnHm-R | (CH3)2CHCH3 isobutane |
| フェニル基 | ベンゼン環 C6H5-R | ||
| アルコール | 水酸基 (ヒドロキシル基) | R-OH | (CH3)2CHOH isopropanol |
| エーテル | R-O-R' | CH3OCH3 dimethyl ether | |
| アルデヒド | アルデヒド基 | R-CHO | CH3CHO acetaldehyde |
| ケトン類 | ケト基 (カルボニル基) | R-CO-R' | CH3COCH3 acetone |
| カルボン酸 | カルボキシル基 | R-COOH | CH3COOH acetic acid |
| エステル | R-COO-R' | CH3COOCH2CH3 ethyl acetate | |
| アミノ化合物(アミン) | アミノ基 | R-NH2 | CH3NH2 methylamine |
| ニトロ化合物 | ニトロ基 | R-NO2 |
|
CnHm: 炭素と水からなる化合物の総称 (s.l.)
⇒ s.l.の中の天然物質 (s.s.) → 炭素化合物の母体 分類 (classification)_____________1 かけ 2 かけ 3 は 6炭化水素の5種: 1 × 2 × 3 = 6 ___________単結合 2重結合 3重結合 環 6角 A. 飽和炭化水素単結合(一重結合)のみからなる = 飽和a). 飽和鎖式炭化水素 acyclic
直鎖構造(ex. n-butane)か分枝構造(ex. i-butane) Ex. シクロブタン C4H8, シクロヘキサン C6H12 B. 不飽和炭化水素C·C間に二重または三重結合を持つ部分がある = 不飽和a) 不飽和鎖式炭化水素 代表: エチレンC2H4 (CH2=CH2) アセチレンC2H2 (CH≡CH) プロピレンCH3-CH=CH-H, メチルアセチレン CH3-C≡C-H b) 不飽和環式炭化水素(芳香族炭化水素aromatic hydrocarbon): 不飽和度高、安定
Ex. ベンゼンC6H12 (1858 Kekule: 価標原子価結合 → 古典的構造論) 別分類鎖を先に考える
IUPAC炭化水素命名法直鎖アルカン→ ギリシア語数詞, [Gr]
|
ケトン ketone: R-C(=O)-R'アセトフェノン acetophenone ⊂ 芳香族ケトン
= 1-フェニルエタノン (1-phenylethanone-1one), IUPAC |
アルカン alkane製法1) 脱炭酸法: 無水カルボン酸ナトリウムと固体水酸化ナトリウムを混合・加熱分解R-COONa + NaOH → R-H + Na2CO3, R: アルキル基
CH3COONa (酢酸ナトリウム) + NaOH → CH4 + Na2CO3 CH3CH2CH3 + Na2CO3 2. 熱分解 (クラッキング)CH3(CH2)6CH4 → [500°C, 25-70 atm] → CH3(CH2)2CH3 (ブタン) + CH2=C(CH3)2 (2-メチルプロペン) ↳ CH4 (メタン) + CH3CH=CH2 (プロピレン) 物理的性質1. 溶解度 (H2O g/100 ml)電気陰性度 C = 2.5, H = 2.1 → 極性殆どない → 水(極性溶媒)に不溶 Ex. CH4: 電子の偏りがない 溶解度: 多 CH4 (0.025) > C2H6 > C3H8 > C4H10 > C5H12 > C6H14 少 (Cp. alcohol 溶解度 -OHは親水性)
H-O···H-O···H-O···H-···
例外: 
エタン ethane CH3-CH3 → Neumanの投影法(1955) 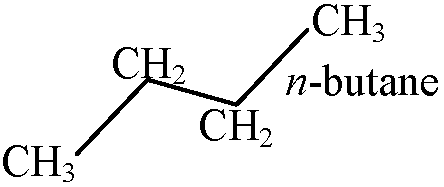 ねじれ形: 安定 = 手前と奥のHの距離が最も短い
ねじれ形: 安定 = 手前と奥のHの距離が最も短い重なり形: 不安定 = 完全な free rotation とは言えない ねじれ形立体配座 71 = trans or anti形, 73, 75 = gauche形 all trans形も安定(ジグザグ形)液体程度まで回転運動するが、固体では回転運動殆どしない
CH3-CH2-CH3 → CH3-CH=CH2 → (-CH(CH3)-CH2)n 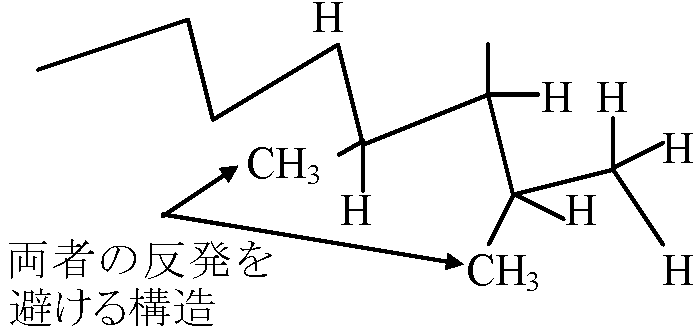 アイソタッチ型(微視的): この反撥は避けられないので自然に捩れ生じる
アイソタッチ型(微視的): この反撥は避けられないので自然に捩れ生じる→ ヘリックス型(Helix structure, 巨視的): 全体でコイル型螺旋系
微視的 = all trans型/巨視的 = Helix構造 - 全体として伸び縮みし易い (Cf. アミノ酸: L型が生物) 燃焼(酸化)
完全燃焼: CH4 + 2O2 → CO2 + 2H2O(l) + 891 kJ ⇔
第1段階 Cl-Cl → 2Cl· (光分解) → 脂肪族環状炭化水素= cyclic aliphatic hydrocarbon or alicyclic hydrocarbon (シクロアルカン), CnH2n (n ≥ 3)1. 環式化合物: 単結合は自由回転不可能 2. 2種の置換体のあるものは異性体存在 → cis, transを必ず明記
a) cis-1,2 dimethyl cyclopropane Ex. HOCOCH=CHCOOH: シス型 = マレイン酸, トランス型 = フマル酸 |
環状化合物の形
sp2-like sp3 = 109.5 Neumann投影法で見る →
Chair form = 1-2, 2-3, 3-4, 4-5, 5-6, 6-1 (全てgauche型) エネルギー差 = boat – chair
= (2 × 重なり形 + 4 × gauche形) - (6 × 重なり形) → chair formの方が安定: 存在比 = (chair form):(boat form) = 1000:1
Ex. methylcyclohexane
反転繰り返しchair form, boat formになっても必ずaxial, equatorialがある
methylはいずれもtransの関係にある
→ axialとequatorialの2種はエネルギー差存在 → 1.6 Kcal位の差が同じchair armのものでも存在
現実: この部分が反転 → cis, transを考える必要なし
C-Cl間に注目 |
|
結合エネルギー: C-C: 83 kcal, C=C: 145 kcal π: 62 kcal → π結合の結合力大きいためC=Cは回転していない 同属体
n = 3: CH3-CH=CH2
脱水はより水素の少ない方から生じる
二重結合: 1 mol付加 CH3CH=CH2 + H2 → CH3CH2CH3, CH3C≡CH + 2H2 → CH3CH2CH3 ハロゲン付加 → 2, 3重結合検出に利用 Q. エチレン・エタン混合気体 1.12 l (0°C, 1 atm) → 臭素水に通す → 6.4 gの臭素が付加 (Br = 80)(1) 反応式、生成物の構造式、異性体の構造式を書け。(2) 6.4 gの臭素は何モルか。(3) 臭素と反応した物質は何モルか。(4) もとの混合気体中の両気体のモル数を求めよ。(5) もとの混合気体の各物質の質量を求めよ。(6) もとの混合気体に触媒を用いて水素を付加させる時、0°C, 1 atmで何lの水素が反応するか |
A. (1) エタンC2H6は飽和炭化水素なので臭素と反応しない
∴ C2H4 + Br2 → C2H4Br
(2) Br2 = 160 ∴ 160 g = 1 mol ∴ 6.4 g = 6.4/160 mol ⇒ 0.040 mol
0°C, 1 atm, 1.12 lの気体 → 1.12/22.4 = 0.050 mol
(5) エタン = C2H6 = 30 ∴ 30 × 0.01 = 0.30 g 付加する水素はエチレンと同じモル数 ∴ 22.4 × 0.040 = 0.90 l Def. 縮合反応 condensing reaction: 低分子量の物質が外れることにより2分子から1分子が生成する反応Ex. A + B → C + H2O Def. 重合反応 polymerizing reaction: 分子量小さい分子が結合し、高分子化合物を生成する反応
モノマー(単量体) monomer → ポリマー(重合体) polymer オリゴマー oligomer: 比較的少数のモノマーが結合した重合体 モノマーの数 ⇒ ダイマー(二量体) dimer、トリマー(三量体) trimer、テトラマー(四量体) tetramer … |
|
不斉炭素(不整炭素): sp3混成である炭素原子に結合する4つの原子(団)が全て異なる炭素 1) CH2-CH(OH)-COOH 2) HOOC-CH2-CH2-CH(NH2)-COOH: 鏡像異性体 → 生理作用にも関連 3) ベンゼンヘキサクロライドbenzene hexacloreid (BHC): 9種存在(内2体に殺虫効果あり体内蓄積性がある)
低分子-高分子 電子論1)___C2H5-OH___アルコール__中性___-OH結合型_sp3____C6H5-OH___フェノール___弱酸性___________sp2 ____CH3-COOH_酢酸_______酸性_____________sp2 酢酸はカルボニル化合物 → 全てpH異なるがこの説明は電子論で可能 2) o-, m-, p-の3種の異性体の存在が予測されるがm-の位置しかニトロ化されない → 共鳴理論(電子論)
立体異性体異性体 isomer
構造異性体 structural-isomer
光学異性体 optical-isomer 1) 光学異性体(光学正四面体)= 鏡像関係にある異性体
一般式 CW2X2 (or CW2XY): 炭素につく置換基のうち2種が同じなら異性体存在しない
→ alkaneは正四面体構造と予測 → 対称体 enantiomer antipode L体D体決定法→ 観察方法: stereochemistry的に立体配置configurationを調べる Def. 光学活性: 光の振動面を旋回させる性質 → Def. 偏光度: 偏光面の回転角度
光 → レンズ → 偏光プリズム[光路] → プリズム → レンズ → 目 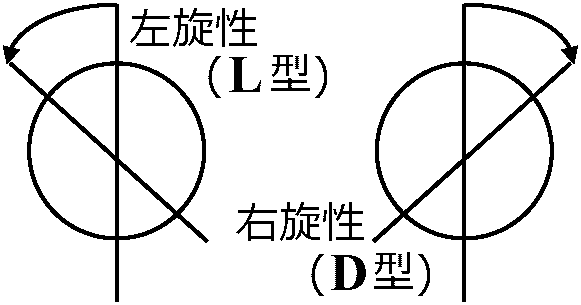 Def. 比偏光(旋光)度 specific rotation [α]tD
Def. 比偏光(旋光)度 specific rotation [α]tD= 測定した旋光度(°)/{管長(dm) × 濃度(g/100 ml)}
t: 測定温度, D: ナトリウムD光線5893Å 偏光面を施す: 光学活性 optical active → 施光性を調べる
右旋性(D型, dertravotatory): 偏光面を時計方向に回転 (時計回り clockwise rotation) → 右旋糖 dextrose (以前) グリセルアルデハイド値を基準にL型D型決定 → (今)旋光性だけで型は決定できないことが判明
合成品(一般)- d:l = 1:1
2) 幾何異性体 geometric isomera) 二重結合による異性体Ex. 2-butene: CH3-CH=CH-CH3 → 3種ある
|
c) アレン(分子不斉)
sp2, sp: 対称性存在 → 不斉炭素はないが分子全体として実像と虚像の関係の異性体が存在
d酸: m.p.159°C [α]D = +437°C ↔ l酸: m.p. 139°C, -437°C
原則: 不斉炭素がn個の場合2n個の異性体存在 → 対称体の関係が成立している分けではない diastomer: 立体異性体以外の関係のもの Ex. 酒石酸 HOOC-CH(OH)-CH(OH)-COOH: 異性体2n-1個存在 炭素以外の不斉原子
ブドウ糖 → l(-)-酒石酸
→ セロハン内に残る成分が加水分解酵素 光学分割 optical resolution= 光学異性体の分離 1) 酵素反応 (±)-C6H5-CH(OH)-CH3 メチルフェニルカルビノール
→ (CH3CO)2O (アセチル化), 触媒 l-ブルシン →
天然の酵素反応は更に立体特異反応と考えられる 酸あるいは塩基触媒
I_____________II 1848 Pastur L
酒石: (+)-硝酸塩カリウム塩, メソ酒石酸カリウム塩, ブドウ酸カリウム塩, (±)-酒石酸ナトリウム・アンモニウム塩 (ブドウ酸)
天然 Pastur L
[(+)-酸·l'-塩基]塩 (1) diastomer: 分離可能 ∵対称性が失われている
H+ or OH- |
C6H6, ベンゾール (独)
ベンゼンの構造と芳香族化合物命名脂肪族芳香族 (不飽和度高、安定)
Kekuléの推定(1865)C6H6__1) 1置換体 = 1種, 2置換体 = 3種, 3置換体 = 3種______ 2) 条件によって付加反応を示す 以上を基にbenzene構造を推定し、共鳴理論により実証された
Benzeneの表わし方1) Renonance概念導入
1993 Pouling: 共鳴法or原子価結合法: "化学結合論 The nature of chemical bond"
1, 2: Kekulé’s benzene, 3-5: Städelen-Wiehelhaus’s benzene
b) 極限構造式 1-5
Ex. C6H6 → 共鳴混成 36 kcal = 共鳴エネルギー Cf. CH2=CH-CH=CH2 → CH3-CH2-CH2-CH3 + 57.1 kcal 差3.7 kcal → Def. 非局在化エネルギー(共鳴エネルギー): この3.7 kcal 環状系共役系: 異常安定化, aromatic: 巨大なものほど大きなkcal値
X-ray (1934) → benzeneはsp2の正六角形(1.40Å) →
シクロオクタテトラエン: 2重結合局在化, 不飽和性
n =______0___1___2___3
非共有電子対(孤立電子対) lone pair, lp: 不飽和結合に結合
Ex. H-Cl: H-Cl ⇔ H+ + Cl- a) 電子をbenzene環に押し出す
|
b) Benzeneの密度を小にする(電子を引き付ける)
芳香族置換反応親電子試薬による
alipathic -CH-CH- → [付加反応] → -CH(E)-CH(X)- (E = +, X = -)
(75%放射性) b) アルキル化 (Friedal-Craft法)
CH3-CH2Cl → CH3CH2(+) Hの転移 → CH3-C(+)H-CH3 CH3-CH2-CH2-CH2Cl → CH3-CH2-CH2-CH2(+) → CH3-CH2-C(+)H-CH3 3) alcohol or alkaneを用いる(H2SO4, H3PO4, etc.)
CH2=CH2 + [H+] → CH3-CH2(+) クメン法 CH3(CH3)-CHOH + [H+] → CH3(C(+)H3)-CH + H2O c) アシル化(R-C(=O)- アシル基)
R-COOH → [PCl2 or SCl2] → R·COCl → [AlCl3] → R·CO(+) + AlCl4
i)
X= -NR2, -OH, -Cl: Alkyl(活性基); o, p-配向性
X:_______-OH__________________-NO2
o:p比: X = -CL: スルホン化 = 0:100, ブロム化 = 11:87 (m, 2), クロール化 = 35:55 |
(IUPAC規約)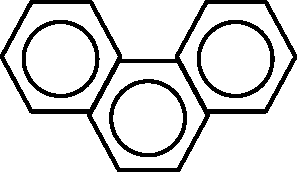 ナフタリン______アントラセン__________フェナトレン(染料) → 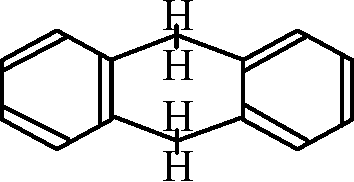 ジヒドロアントラセン (Hydro-, 水素添加) ジヒドロアントラセン (Hydro-, 水素添加)HBr: peptide脱離に利用, ハロゲン化
アレン allene物理的性質
A. 赤外線IR
1500 or 1800 cm-1: 芳香環 C-C 伸縮非常に強い(very strong, v.s.)
分子吸光係数高い吸収スペクトル与える → 200/250-270 nm: 強い吸収示す
I(-), Xδ(-)-Yδ(+)_____________(-)が直鎖型炭化水素等と反応
芳香族の反応: 置換・付加・酸化: 親電子反応が最多 ハロゲン化 / ニトロ化 / スルホン化 / アルキル化 / アシル化
マルコニコフの付加反応の法則による ex. 脂肪族: Benzene環は付加反応をし難い 置換試薬の本性Ex. ニトロ化
_______→ [Br2, FeB3] → _______→ [Cl2, FeCl] → _______→ [D2SO4] → _______→ [CH3CH2Cl(RX), AlCl3] → _______→ [CH3CH=CH2] → _______→ [H3PO4, CH3COCl, AlCl3] → A. ナフタリン (naphthaline)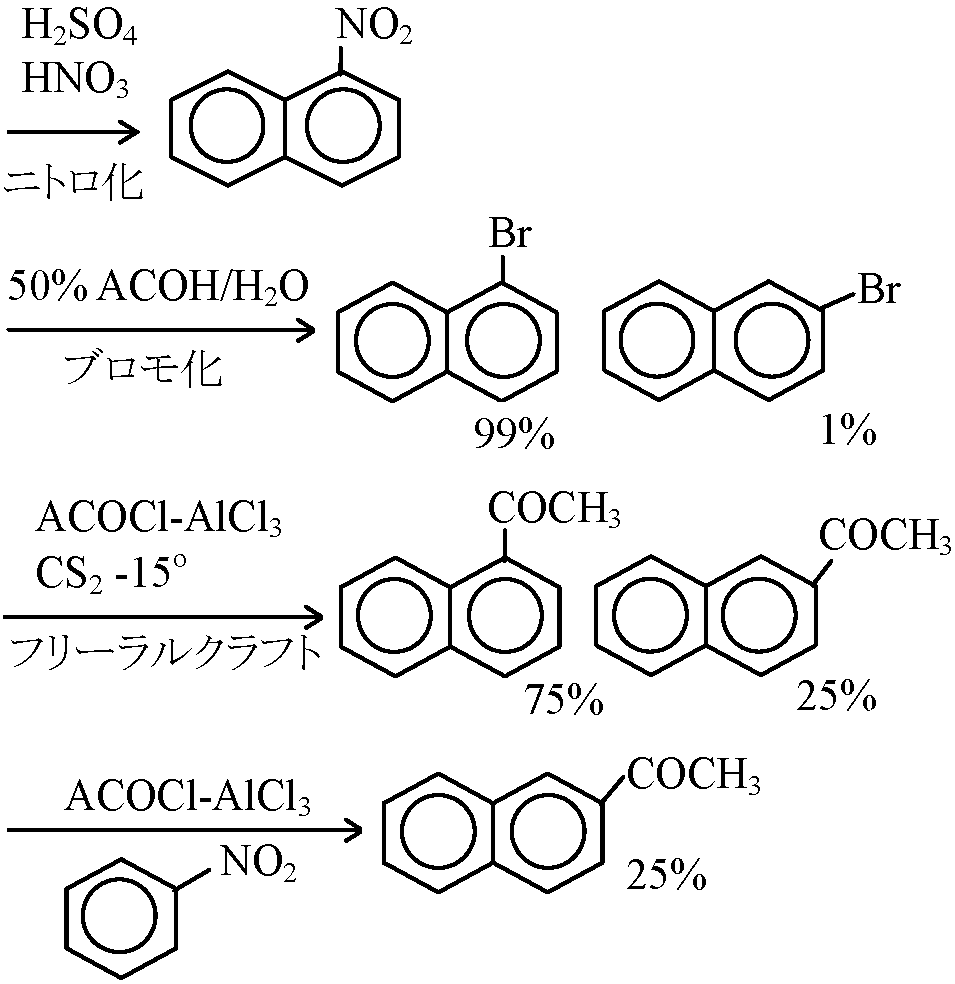
α-置換 B. フェナトレン (phenanthrene, C14H10)
スルホン化 ニトロ化 (速度比) C. アントラセン (anthracene, C14H10)9, 10の反応基はalkeneに近い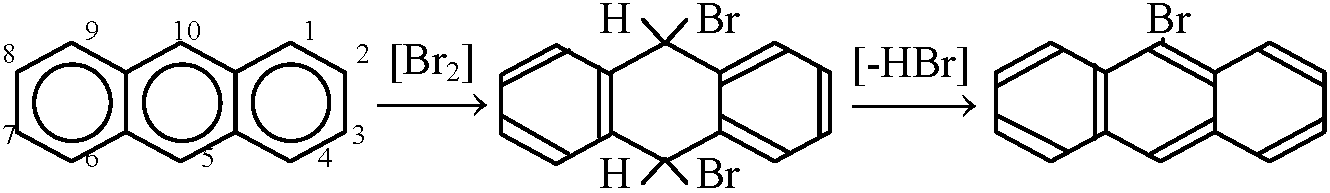 Areneの付加反応: 通常の方法では非常に困難
置換基がついていると付加に有利 |
CrO3, KMnO4, H2O2, OSO4(酸化オスミウム)等一般的酸化試薬には反応しない ____
__1. O2________ O=CH___O=C-C=O 芳香族炭化水素の原料raw materialと用途A. 石炭からの芳香族 cp. 石油: normal, cyclicグラファイト状。石炭の還流。N, OH等のついたものが石炭中には多い B. 石油からの芳香族 - 有機工業原料として有利
非ベンゼン系芳香族化合物A. アズレン: 青色, 5因環及び7因環
C. アヌレン (annulene): 同一平面、非局在化、芳香性
共役環状ポリエン (cf. ブタジエン等の範疇)
シグママンタジエン: π錯体, 非常に安定な橙色の結晶, m.p. 173°C: 金属カルボニルとの錯体 芳香族ハロゲン化合物親族芳香族置換 SN1, SN2 (cf. 求核置換)
Ex. ハロゲン化アルキル、ハロゲン化ベンジルに比べて低い C-Brの解離エネルギー
ダイオキシン類 dioxins
mw = 154.2 ビフェニル biphenyl の水素が塩素に置換されたもの =
ポリクロロジベンゾ-パラ-ジオキシン (PCDDs) + 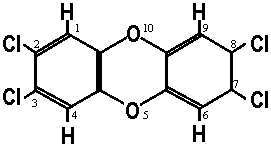 → 環境ホルモン
→ 環境ホルモン
PCB (ポリ塩化ビフェニル)ベンゼン環が2つ結合した塩素を含む有機化合物
|
糖質 ≈ 炭水化物一般式Cm(H2O)n: 多価アルコールのアルデヒドやケトン誘導体、及び近縁な誘導体を含む物質群
(CH2O)n, Cn(H2O)n: Oが少ない、Nが多い等、当てはまらないものある 基本骨格単糖: 単糖がグリコシド結合により縮合したものを単糖数により2糖・3糖・多糖等に分類単糖類
五単糖 (pentose): C5H10O5, 炭素原子5個含む。順にC1, C2, …, C5と番号 |
二糖類 (12), C12H22O11: ショ糖 succaride、麦芽糖、乳糖 多糖類 (6n), (C6H10O5)n: デンプン、セルロース、グリコーゲン、ペクチン、デキストリン オリゴ糖: 糖鎖中で結合している単糖が少ないもの(通常 < 15個) 機能
|
単糖類ウロン酸単糖を酸化し得た誘導体の中で、主鎖末端ヒドロキシメチル基(-CH2OH)がカルボキシル基(-CO2H)に変わったカルボン酸D-ガラクトロン酸 (D-galacturonic acid)
D-グルクロン酸 フコース fucoseC6H12O5
ペプチド状物質peptic substance: Gal. Aが束になったもの(polymer) L-フコース L-fucose (6-deoxy-2-galactose) 五炭糖 (pentose): C5H10O5 Ribose, Deoxyribose, D-xylose L-arabinose
ブトウ糖 D-glucose (Glu), D-galactose (Gal), D-mannose (Man) L-ラムノース L-フコース (L-phamnose or 6-deoxy-L-mannose) (L-fucose or 6-deoxy-L-galactose)
glycogen, starch → glucose-1-phosphate, glucose-6-phsphate
______ OH_OH
_____ H__ H___H________________ H__ H___H グルコース (ブドウ糖) glucose= デキストロース (dextrose), Glc, Tz→ α型, β型
α型、β型ともにピラノーズ型: エネルギー差により安定なaxial型(β型)の方が溶液にするとグルコース全体で自然と増える
α-D-glucose:β-D-glucose = 1:2 - 安定
糖が環状をとった場合の化学的性質はヘミアセタール
ピラノーズ型: ピラン環を持つ
光学異性がある
4単糖 5単糖 6単糖
Chiral 2 3 4
異性体 22(4) 23(8) 24(16)
溶液中で一本鎖の状態で存在しているとは考えられない → 理由1) 典型的なアルデヒド反応を示さない
R-CH=O + R'NH → RCH=NR' + H2O
D-glucose |
環が6角形である理由
環の大きさ 5 6 3 7 4
形成速度 5·104 8.5·102 6 14 1
安定性(熱力学的)
グルコースは鎖状、環状(pyran型, furan型)等の混合状態で存在するが環状(中でもβ-型)が安定
初速は鎖状の方が早いがしばらくすると安定し環状になる CH2OH(HCOH)4CH2OH → [NaH2, 還元] → CHO(HCOH)4CH2OH → [Br2, 酸化] → COOH(HCOH)4CH2OH 二糖類(グルカン) disaccharide, glucanEx. trehalose, gentiobiose, lactose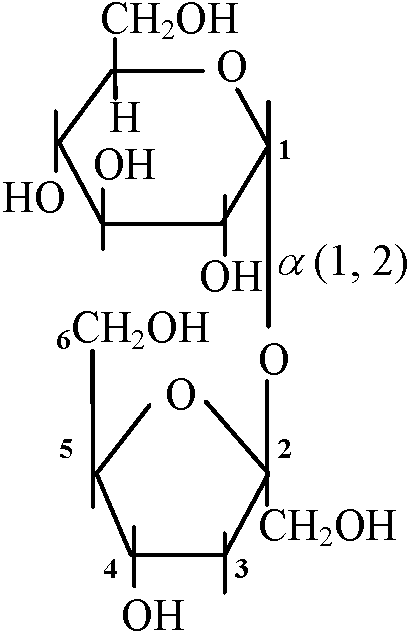 麦芽糖 maltose: 2つのα-glucose単位 → α-1,4-glucoside (α-1,4結合)
麦芽糖 maltose: 2つのα-glucose単位 → α-1,4-glucoside (α-1,4結合)
メチル基が(DNAに)つく現象 メチル化 ↔ 非メチル化 [メカニズム] 水酸基による求核置換反応 → R-OH + CH3-X → R-O-CH3 + HX
自由エネルギーfree energy 多糖類ペプチド状物質 peptic substances Gal Aが束(ポリマー)polymerになったもの デンプン starch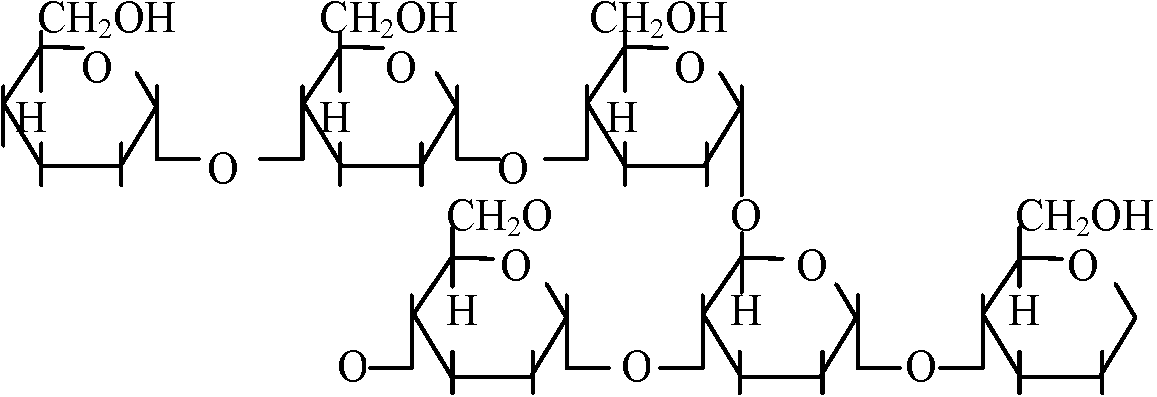 amylose: amylopectin canyloseの枝分かれしたもの homopolymer: 一つの糖がつながって出来ているもの glycan(総称): glucan, mannan等 ペプチドグルカン peptideglycan細胞壁 Nアセチルグルコサミン / Nアセチルムラミン酸 ↓ つながっている L-Ala: CH3CH3CO-NH(HCCH3)-CO, D-Glu: NH-CH((CH2)2COOH)-CO L-Lsy: NH-CH(CH2)24NH2)-CO, D-Alg: NH-CH(CH3)-COOH ヒアルウロン酸: カニの甲羅やエビの殻に含まれる 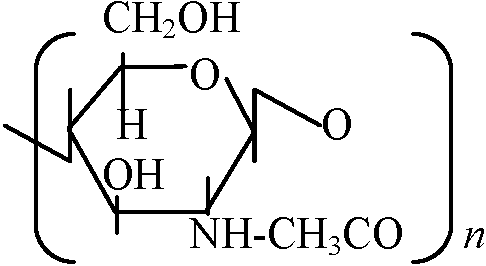 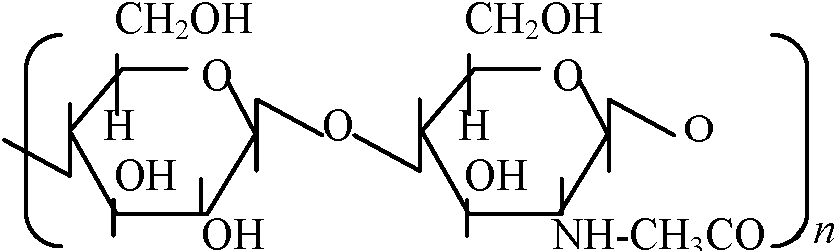 Nアセチルグルコサミン____グルコロン酸_______Nアセチルグルコサミン 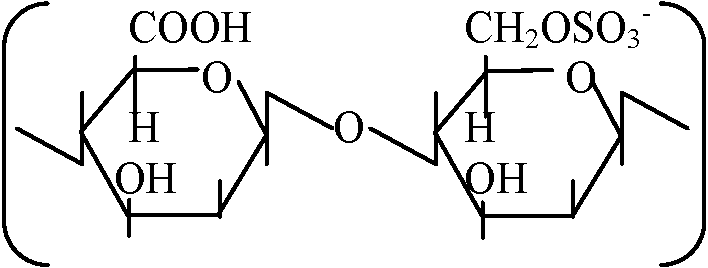 コンドロイチン酸 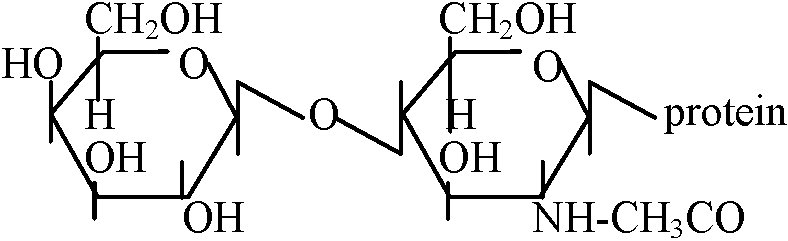 ガラクトサミン: 南極の魚の血清、糖タンパク Q. 以下に示すグルコースの鎖状構造を環状構造に書き直せ
H H OH H |
|
Def. 少なくとも一つのカルボキシ基(−COOH, -C(=O)OH or -CO2H)を有する有機酸 → 一般式 R−COOH (R: 一価の官能基) 分類脂肪酸: 鎖状炭化水素基(Ex. アルキル基)にカルボキシル基が結合したもの
飽和脂肪酸 不飽和脂肪酸C 構造(名称): m.p./b.p., 解離定数1__= HCOOH (蟻酸): 8.4/100.5, 2.1 × 10-4 - 液体状態で会合(2量体) 2__= CH3COOH (酢酸): 16.7/118, 1.8 × 10-5 - 氷酢酸は純粋に近いもの 3__= CH3CH2COOH (プロピオン酸): -21.5/141.1 1.3 × 10-5 4__= CH3(CH2)2COOH (酪酸): -7.9/163.5 1.5 × 10-5 5__= CH3(CH2)3COOH (吉草酸): -34.5/186.5 16 = CH3(CH2)14COOH (パルミチン酸): 63/351 |
18 = CH3(CH2)16COOH (ステアリン酸): 69-72/376 - 常温で白色固体
HCOOH → [H2SO4, Heat] → CO + H2O 多価カルボン酸m.p./b.p., 解離定数琥珀酸: HOCO(CH2)2COOH = 185/235, 6.3 × 10-5, 2.5 × 10-5 酒石酸: HOCO-CH(OH)-CH(OH)-COOH = 170 m.p., ブドウ果実に豊富 リンゴ酸: HOCO-CH2-CH(OH)-COOH = 130.8 m.p., リンゴ・ブドウ果実 クエン酸: HOCO-CH2-C(OH)(COOH)-COOH = 100 m.p., レモン、ミカン、ウメの実 芳香族カルボン酸 aromatc carboxylic acidベンゼン環にカルボキシル基が直接結合した有機化合物 |
|
Def. (s.l., 化学) アミノ酸: 1つの分子の中にアミノ基(-NH2)とカルボキシル基(-COOH)を持つ化合物
α-β-γ-アミノ酸: 順次隣のCに移るのでこう呼ばれる
天然アミノ酸 (natural amino acid, NAA)1) 非極性アミノ酸疎水性R基を持つアミノ酸。脂肪属アミノ酸及び芳香属アミノ酸とプロリン光学異性体: 偏光プリズムを利用し発見。アミノ酸はグリシン(R=Hなので)を除くと光学異性体存在 1) グリシン (glycine, Gly, G), 2) アラニン alanine, Ala, A), 3) ロイシン (leusine, Leu, L), 4) イソロイシン (isoleusine, Ile, I), 5) メチオニン (methionine, Met, M), 6) フェニルアラニン (phenylalanine, Phe, F), 7) トリプトファン (tryptophane, Trp, W), 8) プロリン (proline, Pro, P), 9) バリン (valine, Val, V)
プロリンのあるところでは結合が乱れ90°角度が変わる 2) 極性だが電荷のないアミノ酸多くは水素結合可能なR基をもつ。水酸基、SH基、酸アミド基を持つものある10) セリン (serine, Ser, S), 11) スレオニン (threonine, Thr, T), 12) システィン (cysteine, Cys, C), 13) チロシン (tyrosine, Tyr, Y), 14) グルタミン (glutamine, Gln, Q), 15) アスパラギン (asparagine, Asn, N) 3) 電荷を持つアミノ酸i) 正電荷を持つアミノ酸 positively-charged amino acids第2のアミノ基を、グアニジル基を、または、弱塩基性イミダゾールを持つもの 16) リジン (lysine, Lys, K), 17) ヒスチジン (histidine, His, H), 18) アルギニン (arginine, Arg, R) ii)負電荷を持つアミノ酸19) グルタミン酸 (glutaminic acid, Glu, E), 20) アスパラギン酸 (asparatic acid, Asp, D) タンパク質はこれら20種のアミノ酸の結合構成により決定される4) 非タンパク質性のアミノ酸タンパク中に存在しないものグラミシジンS, D-Phe, D-Val, D-Ala, D-Gluなど → D型アミノ酸は自然界にはない 解離NH2CHRCOO-NH2CHRCOOH or +NH3CHRCOO- +NH3CHRCOOH ______________pK1____________pK2 +NH3CHRCOOH ⇔ NH2CHRCOOH ⇔ NH2CHRCOO- +NH3__________⇔ NH2+ H+ +NH3CHRCOOH ⇔ +NH3CHRCOO- ⇔ NH2CHRCOO- dipolar ion -COOH________⇔ -COO- + H+
|
1. CH3COOH, CH3NH3: -COOHの動きに注目
pH__4.74 ⇔ CH3COO- + H+
RCOOH ⇔ RCOO- + H+ -1000 cal/mol
pI (等電点) = (pK1 + pK2)/2 = 6.02 非極性鎖側極性・電荷を持たないpK1 pK2 COOH NH 側鎖 G 2.34 9.60 C 1.71 10.4 8.5 -CH2S H⇔-CH2S-+H+ A 2.35 9.69 Y 2.20 9.11 10.07 -CH2-C6H4-OH⇔-CH2-C6O4-O-+H+ V 2.32 9.62 K 2.18 8.95 10.52 -(CH2)4NH3+⇔-(CH2)4NH2+H+ L 2.36 9.60 H 1.82 9.17 6.0 I 2.36 9.68 R 2.17 9.04 12.98 M 2.28 9.21 D 2.09 9.83 3.86 -CH2COOH⇔-CHCOO-+H+ F 1.83 9.13 E 2.19 9.67 4.25 -(CH2)2COOH⇔-(CH)COO-+H+ W 2.38 9.39 P 1.99 10.60 S 2.21 9.15 T 2.09 9.10 N 2.02 8.80 Q 2.17 9.13 側鎖の違いで多少の差 → 極性や電荷を決定するのは側鎖
pK1 pK2 pK3 [α]025 in 5N HCl
(a) 2.34 9.60 - 0
(b) 2.38 9.39 - +2.8
(c) 2.19 4.25 9.67 +31.8
(d) 2.18 8.45 10.53 +25.9
(e) 1.82 6.0 9.17 +11.8
X線解析 X-ray analysisアミノ酸構造を調べるのに用いられていた → 非極性側鎖・極性側鎖の違いを利用 → 極性側鎖に非極性側鎖が固まって観察される (Wilkins MHF 1952)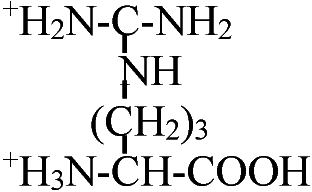 ⇔ ⇔
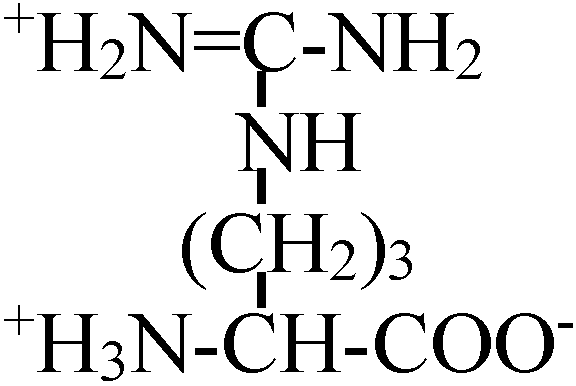 ⇔ ⇔
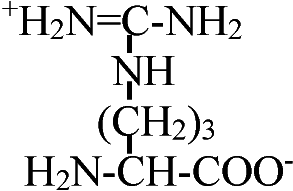 ⇔ ⇔
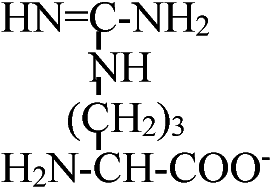 電荷___+2____________+1_____________0_____________-1 pK__________2.17___________9.04___________12.98 Q 1. アミノ酸は中性ではdipolar ionとして存在する。このことを示す実験結果を三つ以上あげ説明せよ Q 2. グリシン、アスパラギン酸、アルギニン、プロリン、チロシンの構造式を書きその特徴をあげよ Q 3. 酢酸とアミノ酸はどちらが強い酸と言えるか。アラニンをアミノ酸の例にとり、酢酸とアラニンの化学構造及びpKを示し、理由を説明せよ |
アミノ酸の番号のつけ方NH2側 = N端(N terminal) - COOH側 = C端(C terminal)⇒ N端から番号をつけC末端が最終となる 一次構造: アミノ酸配列順序 二次構造
α-ヘリックス構造 → 規則的構造 四次構造: サブユニット集合 Ex. ヘモグロビンはααββ構造 立体構造を作る化学結合1. 共有結合a. ペプチド結合 peptide bond
C-N (一重結合) 1.49Å = 自由回転可能
α-ヘリックス β構造(直線構造) - β-ケラチン等________逆平行β構造 - 絹・フィブリン等 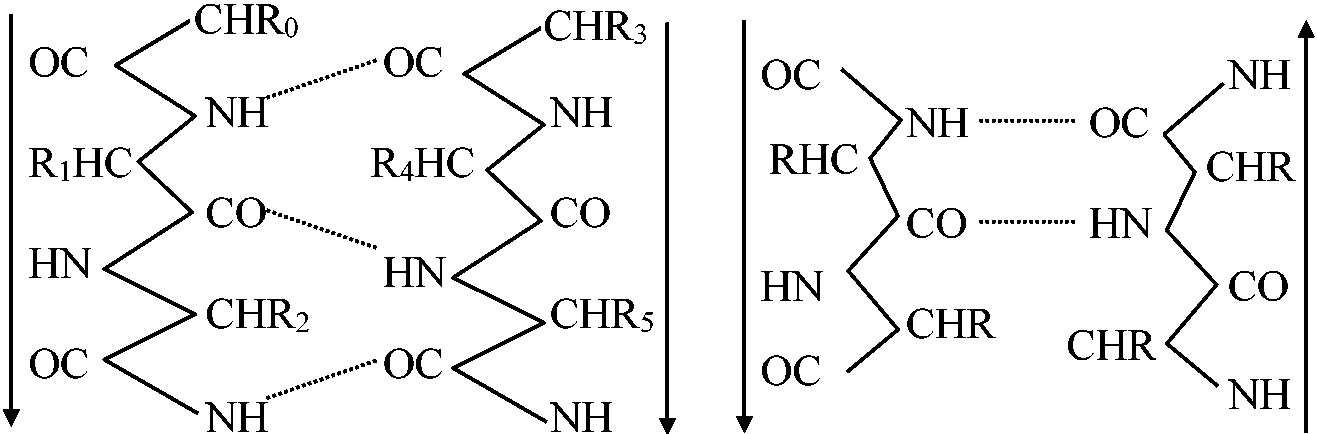 ランダムコイル(ランダム構造): ペプチドが一定構造を示さない場合 コラーゲン構造: 全体を見れば3次構造、部分結合の繰り返しといえば2次構造といえる。始めから3本のポリペプチド結合鎖があり、互いに水素結合で結ばれたもの。3本のポリペプチド鎖は約1000個のアミノ酸からなり、グリシン(1/3)、プロリンとヒドロキシプロリン(1/4づつ)からなる。生物タンパク質の約1/2はコラーゲンであり皮膚下繊維組織細胞間結合物質として機能している b. ジスルフィド結合(S-S結合): 2個のシスティンcystineのSH基酸化で生じる共有結合。他にイオン結合をも行う-SH HS- ⇔ -S-S- + H2 Q. β構造とはどのような構造か2. 非共有結合a. 水素結合: 全体の曲がり方に関与
Case 1: α螺旋のペプチド結合のC=OとH-Nに起こる チロシン: 解離すると分子内で水素結合する b. 疎水結合(無極結合): 無極性のアミノ酸(CH3、メチル基など)は水との親和性がなく(= 疎水性)、水面で油が集まるようにひきつけられる
側鎖が疎水性のものは一般にタンパク質の内側に片寄り親水性のものは外側に集まる |
c. イオン結合: 酸性アミノ酸のカルボキシル基と塩基性アミノ酸は電荷している場合電気的に引き合って結合する d. ファンデルワールス力: 2個の原子が互いに近づいたときに起こる非特異的引力から生じる。分子の接近によって誘起され、絶えず変動する電荷が原因となっている 天然ペプチドグルタチオン glutathione= γ-glutamyl L-cystenyl glycine グルタミン酸、システイン、グリシンが、この順番でペプチド結合したトリペプチド生物に普遍的に存在するペプチド性チオール 還元型GSH ⇔ 酸化型 glutathione disulfide, GSSG (2分子GSHがジスルフィド結合で繋がった分子)
GSH
GSSG 抗生物質ペニシリンG
タンパク質がペプチド結合である証拠遊離アミノ基、カルボキシル基がアミノ酸と比べて少ない → これら両基が結合部位となっていることを示唆
NH2-CHR-COOH = アミノ酸 加水分解によってペプチドができる アルカリ性硫酸銅溶液(ビューレット試薬)をprotein溶液に加えると紫色になる 合成ペプチド + Violet reagent → staining violet アミノ酸 + Violet reagent → 呈色しない タンパク質分解酵素(トリプシン・キモトリプシン・ペプシン・パパイン等)は、peptide bondを切る役割を持つことが合成ペプチドを使った実験で確認された分離・精製・純度の確認方法⇒ 実験手法 (method)構造と機能働き: 原形質の構成成分; 単位膜、酵素性質: 熱に弱い(70-80°Cで変性し本来の機能失う)。強酸やアルカリでも変性 形状: 球状 globular, 繊維状 fibrous, 棒状, 綿状 構造(酵素も同様に分類): 単純タンパク質 simple proteins: アミノ酸だけからなる Ex. ウレアーゼ、アミラーゼ 複合タンパク質 conjugated proteins: 非タンパク質部分を持つ holo protein = apo protein + cofactor
核タンパク質: 核酸と結合: e.g., DNA, RNA (ribosome 40-50%, TMV 95%)
~O リンタンパク質: リン酸と結合
色素タンパク質:
hemoprotein eg. Hb, Mb, cyt c
誘導タンパク質: Ex. ヘモグロビン (ヘム + グロビン) Q. タンパク質の構造の一部から一つのアミノ酸が形成するペプチド結合を含む部分を示した。ペプチド結合を指示し、その性質を説明せよ。主鎖の回転する結合を矢印で示せ。α炭素にαをつけよ
Q. タンパク質の一次構造を決定するために、シアノゲンブロマイドは極めて有用な試薬である。その使用目的と反応機作を示せ Q. ポリアクリルアミドゲル電気泳動法でタンパク質分子量を決める方法を説明せよ |
化学修飾反応の制約
1. アミノ酸側鎖の特異的修飾1) アミノ基 (α-NH2, Lys基)
_________.. N求核性nucleophilicityを利用 i)____..┌───────┐┌┐P-NH2 + (CH3)OC-O-CO(CH3) → [アセチル化(アシル化)] → P-N+H2-C-C(O)CH3 + CH3COO- P-NH-C(O)CH3: アセチル(acetyl)基. -CO-R: アシル基 ii)___..┌─────┐
PNH2 + CH-C=O___→ P-NH-CO-CH2-CH2-COO- + H+
P-NH + Dansylchloride
_______H___pH 8-10______NaBH4 i)_______求核置換
⇒ SH定量に利用: λmax = 412 nm, ε = 1.36 × 104 M-1cm-1 (pH = 8) __________p-chloromercuribenzoate 3) ジスルフィド結合 (-S-S-) i) 還元 i-1)_____↙¯¯¯¯↖..
P-S-S-P + HS-CH2CH2OH βmercaptoethanol
P-S-S-P +__>S=O → P-S- + P-S-SO3-
-SH (システィン, Cystein) -S-S- (シスチン, Cystine) → -SO3H e.g., H2N-CH(CH2-SO3H)-COOH システィン酸 - アミノ酸分析にかける P-S-S-P + HCO(OH) → P-SO3H 4) カルボキシル基 α-COOH, Glu, Aspi) エステル化________________HCl
P-COOH + CH3OH HCl HCl → CO-OCH3 + H2O
i) カルボキシメチル化
__..↗¯¯¯¯↘
P-S-CH3 + H2O2 → P-SO-CH3 スルフィキサイド (sulfoxide) iv) 逆供与結合(back donation)
P (ローズベンガル, 色素)____酸化
__O2
i)___ 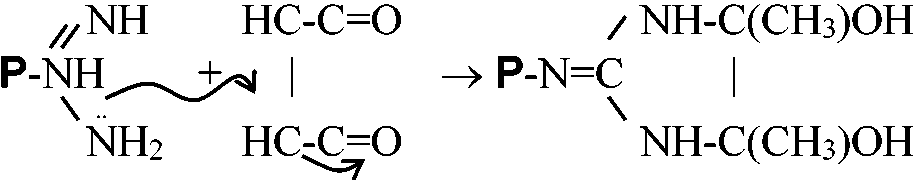 ______2-3 Butanione ii)
|
8) 芳香族水酸基 Thr i) アセチル化__________________pH 7.5
P-
P-
P-
2. タンパク質の特異的修飾1) 親和性標識(affinity labeling)による修飾
His-57活性部位active siteに入って切断する TLCK: histidineに対する特異的基質。Ser-195 in CT, Met-192 in CT 2) 偽基質(pseudo-substances)による修飾
i) 2-bromoacetamide-4-nitrophenol
NHCOCH2Br +
i)__
これをタンパク質に加え、その架橋状態によりCysの位置がわかる  架橋距離 6.7-7 Å 架橋距離 6.7-7 Åiii)__Glutalaldehyde COH-(CH2)3-C(=O)H iv)__Bisazobenzidine N2+- 7) 可逆的修飾
→ i) CT (trans-cinnamoylinidazole)
Trans |
| アミノ | Cys | Tyr | His | Arg | カルボキシル | Trp | シスチン | Met | Ser, Thr | 脱離条件 | |
| アルキル化、アリル化 | |||||||||||
| アロ酢酸、アミド | + | + | + | ± | + | ||||||
| ヒドロキシニトロベンジルプロミド | ± | ± | ± | + | |||||||
| フッ化シアヌル | + | ||||||||||
| DNFB | + | + | + | + | a | ||||||
| TNBS | + | (+) | |||||||||
| マレイミド | ± | + | ± | ||||||||
| アクリロニトリル | + | + | |||||||||
| エチレンイミン | + | ||||||||||
| ホルムアルデヒド | + | + | + | + | ± | ± | |||||
| メトキシニトロトロボン | + | b | |||||||||
| カルボニル-NaBH4 | + | ||||||||||
| アシル化、その類似反応 | |||||||||||
| アセチルクロリド | + | (+) | +t | (+) | ± | c | |||||
| 無水酢酸 | + | (+) | +t | (+) | ± | c | |||||
| 無水マレイン酸 | +t | (+) | (+) | (+) | (±) | d | |||||
| シトラコン酸無水物 | +t | (+) | (+) | (+) | (±) | e | |||||
| 無水コハク酸 | + | (+) | +t | (+) | +t | f | |||||
| エトキシギ酸無水物 | + | ± | ± | +t | ± | c | |||||
| アセチルイミダゾール | ± | (±) | +t | ± | c | ||||||
| トリフルオロ酢酸チオエチル | +t | (±) | (±) | (±) | g | ||||||
| N-カルボキシ無水物 | + | (±) | |||||||||
| シアナート | + | (+) | +t | (±) | (±) | c | |||||
| フェニルイソチオシアナート | + | ||||||||||
| イミデート | +t | b | |||||||||
| ジケテン | +t | ±t | c | ||||||||
| O-メチルイソ尿素 | + | ||||||||||
| ジアルキルリン酸 | ± | ± | |||||||||
| スルホン酸ハライド求電子試薬 | + | ± | ± | ± | |||||||
| ジアゾニウム塩 | + | ± | + | + | ± | ||||||
| TNM | + | ||||||||||
| ヨウ素 | + | + | + | ± | |||||||
| その他 | |||||||||||
| ジアゾ酢酸誘導体 | ± | + | |||||||||
| 水溶性カルボジイミド | + | ||||||||||
| Meerwein試薬 | + | ||||||||||
| Woodward試薬 | + | ||||||||||
| シクロヘキサジオン | + | ||||||||||
| グリオキシザール | ± | + | |||||||||
| フェニルグリオキシザール | + | + | i | ||||||||
| ハロゲン化スルフェニル | ± | +t | + | a | |||||||
| 亜硝酸 | + | ± | ± | ± | |||||||
| RCMB | +t | a | |||||||||
| 酸化、還元反応 | |||||||||||
| 各種チオール | + | +t | h | ||||||||
| ジチオビス(ニトロ安息香酸) | +t | a | |||||||||
| チトラチオン酸 | + | ||||||||||
| 過ギ酸 | + | + | + | + | |||||||
| 過酸化水素 | + | ± | +t | a | |||||||
| 光酸化 | + | ± | + | + | ± | +t | a | ||||
| N-ブロモスクシイミド | + | ± | ± | + | + | ± | |||||
| NaBH4 | +t | h |
|
分子内に複数のフェノール性ヒドロキシ基(ベンゼン環、ナフタレン環等の芳香環に結合したヒドロキシ基)を持つ植物成分の総称 殆どの植物が含有し8,000種以上 機能(不明な点多)
副作用
フラボノイド (flavonoid)カテキン (フラバノール): ワイン、茶、リンゴ、ブルーベリー高含有殺菌作用 (虫歯菌殺菌)、血中コレステロール低下、高血圧予防 アントシアニン: ブドウ実皮やムラサキイモ、ブルーベリー等の赤紫色をした植物体高含有色素成分 肝機能向上補助 疲れ目解消等に効果? → ロドプシン再合生促進 タンニン: 茶、赤ワイン、柿、バナナ等が含む渋味成分 カテキン同様、殺菌効果 タンパク質と結合し不溶性沈殿を作る → 消化率低下 ルチン rutin: C27H30O16: ビタミンPの1種(ビタミンP ≠ ビタミン, s.s.)
ソバに含まれる エストロゲンと同様の働き larr; アンチエイジング? 大豆イソフラボン → 甲状腺肥大, チロシン濃度低下 レスベラトロール resveratrol, RSV (3,5,4'-トリヒドロキシ-trans-スチルベン)
ブドウ、赤ワイン、ピーナッツ等に含まれる: 効能未詳 |
フェノール酸 (phenolic acid)クロロゲン酸: コーヒーに高含有。消化器、代謝性疾患改善作用エラグ酸 ellagic acidイチゴ等が含む。美白効果 → 化粧品に多用リグナン lignanゴマに高含有。セサミンもこの1種クルクミン curcuminウコンに多く含まれるクマリン coumarinサクラ葉、シナモン、パセリ、モモ、柑橘類に高含有。甘香 (軽油識別剤として灯油・A重油に添加)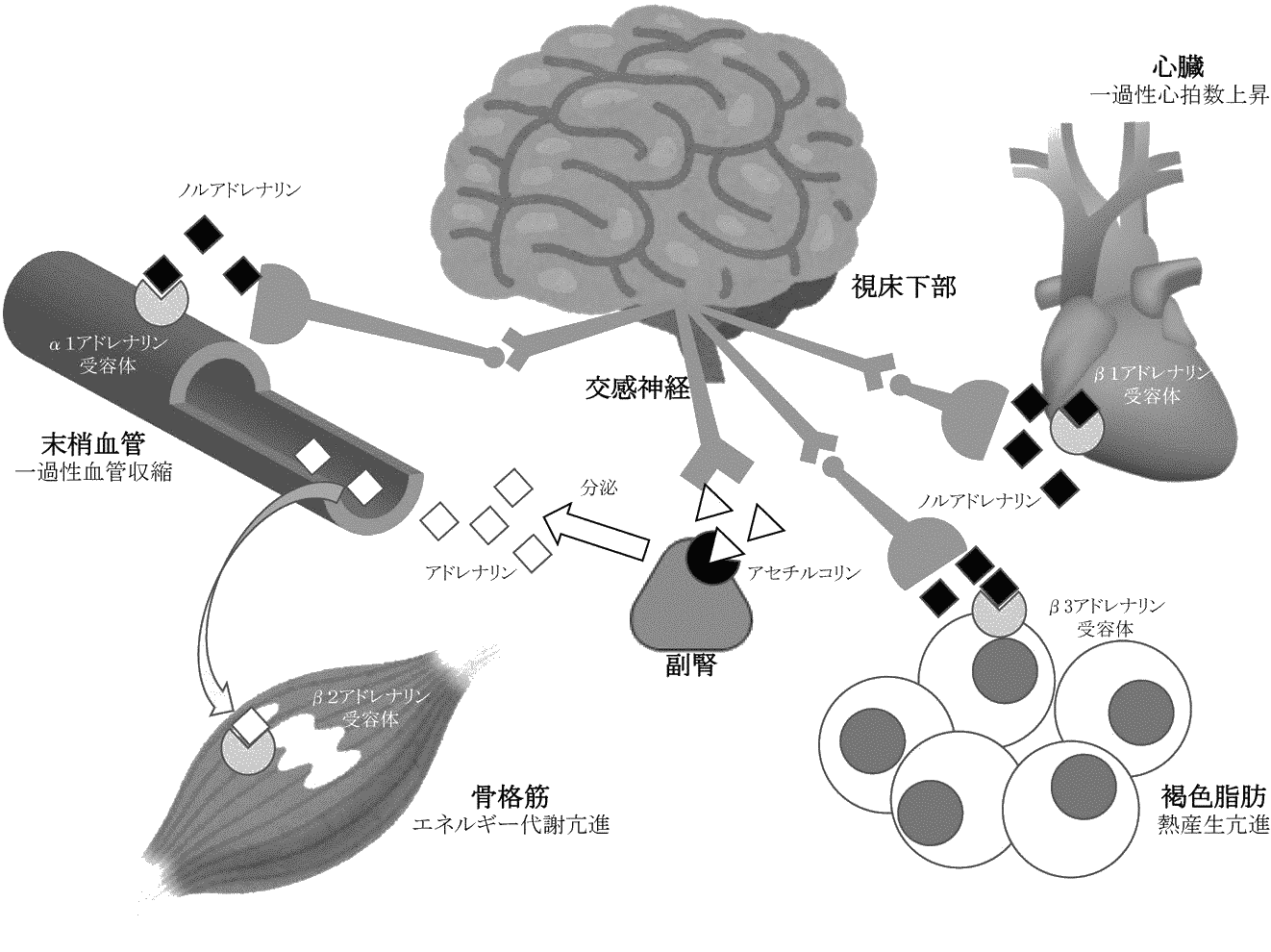 図. ポリフェノール経口投与後の交感神経を介した生理作用 (越阪部 2016) |
|
Def. 生物から単離される水に溶けない物質の総称 → 化学的・構造的性質ではなく、溶解度により定義
Ex. 脂肪酸、中性脂肪、ロウ、リン脂質、糖脂質、テルペノイド、ステロイド、脂肪族炭化水素、脂肪族アルコール、脂溶性ビタミン、カロチン等の脂溶性色素 Def'. 長鎖脂肪酸あるいは炭化水素鎖を持つ生物体内に存在あるいは生物由来の分子生体エネルギー貯蔵、細胞膜や核膜、ホルモン、酵素、血漿等生体組織の成分となり、生理機構に深く関与 脂肪 fat: 生物では後形質として存在(貯蔵養分)
┌─[脂肪酸 1]
[グリセリン]─┼─[脂肪酸 2]
└─[脂肪酸 3]
脂質分類単純脂質CnH2n+2 (nは大)= 非鹸化性脂質 non-saponifiable lipids: 脂肪酸とグリセロールがエステル結合したもの 油脂: グリセロールと結合する脂肪酸の種類により性状異なる
常温: 液体 = 油 oil ↔ 固体 = 脂 fat コレステロールエステル (= コレステロール cholesterol) [ 健康 ] 中性脂質 ワックス waxes: CnH2n+2, 脂肪酸(鎖状カルボン酸) fatty acidsの一部 テルペン terpene ステロイド steroids
glycerol and fatty acidのエステル
1CH2OH CH2OH CH2OH
| | |
2CHOH OHC-H H-COH
| | |
3CH2OH CH2OH CH2OH
mono-acylglycerol = mono glyceride (3種)
CH2OH-CHOH-CH2-OCO(CH2)n-CH3
CH2OP1 CH2OP1 CH2OP1
| | |
CHOP2 CHOP2 CHOH
| | |
CHOP3 tri CHOH di CHOH mono
水に不溶。化学的に不活性。細胞表面で防護目的に使用されやすい |
複合脂質単純脂質に他の成分(リン酸・糖等)が結合したもの。3位のCに結合が多いリン脂質 phospholipid: グリセロールOH基に2長鎖脂肪酸がエステル結合。3番目OH基にリン酸が結合
レシチン lecithine: 脂肪酸、グリセロリン酸、コリンからなる。脳、卵黄、大豆等に多く含まれる リポタンパク質 lipoprotein: (脂質 + タンパク質)複合体
カイロミクロン: 外因性トリグリセライドおよびコレステロール輸送 CH2OH-CHOH-CH2OP3H2: ethanolamine, cholin (polar head group) スフィンゴ脂質 sphinolipids
CH2OH-HCNH2-HCOH-CH=HC-(CH2)13 界面活性剤detergentの働きがある = saponifiable lipids cf. 誘導脂質単純脂質と複合脂質の加水分解で、有機溶剤に溶けて水に溶けないもの。
Ex. 脂肪酸、アルコール: 直鎖アルコール、ステロール、ビタミンA プロスタグランジン prostaglandin, PG動物組織・臓器に含まれる、多様な生理作用をもつ脂肪酸グループ1936: 精液中から分離
当時は前立腺prostate gland由来と考えられprostaglandinと命名
プロスタノイド = PG + トロンボキサン → [医学利用] 陣痛促進剤、消化性潰瘍治療薬 脂肪代謝1) 脂肪 → 炭水化物脂肪: 発芽エネルギーとして子葉に貯蔵。発芽につれ、脂肪 → ショ糖 → 還元糖(ブトウ糖、果糖等)2) 脂肪酸酸化リパーゼとβ酸化lipases and β-oxidation主エネルギー源の炭水化物不足時に、脂肪はエネルギーとして用いられる。リパーゼにより脂肪酸となり脂肪酸C鎖が末端(-COOH側)から次々に2個づつ酸化し、切り離されてC2化合物が生じる。実際は補酵素Aと結合し活性酢酸の形となり、クエン酸回路に入りエネルギー生産に利用される。小胞体膜に反応酵素系があるらしいが精製単離はされていない
lipases: glycerides_____fatty acids β酸化 (β-oxidation): (CH2)n-CαH2-CβH2-COOH, α, β = 酸化部位: β部位酸化をβ酸化という 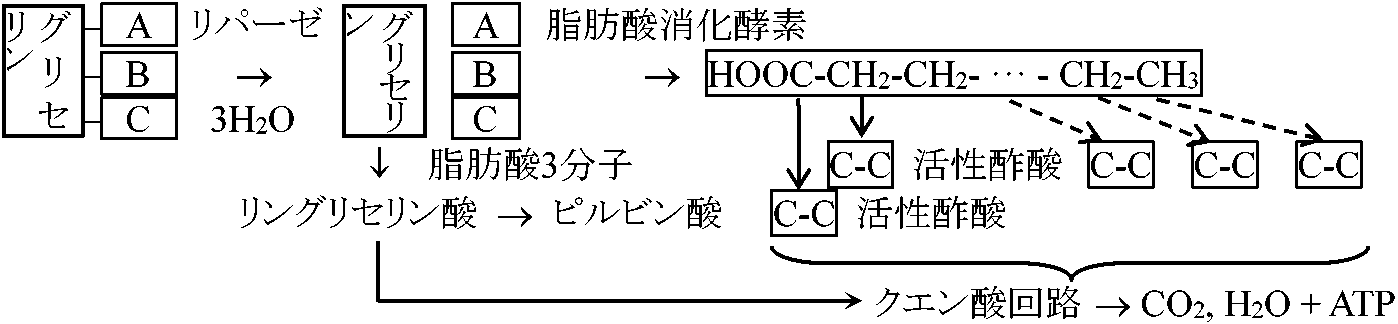
3) 脂肪合成1.2の逆反応脂肪酸が高濃度に貯まると、3分子がグリセリンと反応し脂肪が出来る |