(2021年10月4日更新) [ 日本語 | English ]
HOME > 講義・実習・演習一覧 / 研究概要 > 小辞典 > 水
|
生物構成中心元素は炭素carbon。ついでH2Oが重要
水は物質交代の媒体であり生物の生活は水と切り離すことはできない 表. 原形質構成物質: ムラサキホコリカビ等変形菌の変形体は細胞壁がなく原形質成分を調べるのに適
原形質成分 水 タンパク質 脂質 核酸 無機物質 |
生物体に多い元素 = C, N, H, S, P, 生物体に少ない元素 = Si, Al |
1. 熱力学的特性環境への適合性には水が関与 → 光合成 photosynthesis
Ex. 飲料水 (a) 生活する温度領域T: -20°C < T < 40°C 水の3態: 氷 / 水 / 蒸気 ⇒ 常温で液体
酸素: 我々は気体と意識: T < -183°C = 液体, T < -218.4°C = 結晶 相 (phase)相 密度 剛性 原子・分子配列水蒸気 = 気相 小 無 無秩序 水 = 液相 大 無 無秩序 氷 = 固相(結晶相) 大 有 無秩序(非結晶, アモルファス) 秩序(結晶) 融点 (melting point), MP沸点 (boiling point), BP表. 水とそれに関連する化合物の特性
原子
原子
MP
BP
蒸発熱
|
(b) 密度 density, ρ水 ρwater > ρice (例外的、他にSi, Ge, Bi) ⇔ 多くの物質 ρliquid < ρcrystal効用: 水面から凍る。害: 水道管破裂 温度-密度関係式 density-temperature equation(c) 熱容量, C水: 熱容量大 0.9986 cal/g/K (20°C) ⇔ 液体比熱は一般に0.2-0.5
[液体比熱] ≈ [固体比熱] × 1.2 ⇒ 多くの物質で成立 → 水の比熱は極めて大きく特異な性質
Csand ≈ 1/5·Cwater (d) 表面張力植物毛管現象のように大きな表面張力を発生させる(e) 潜熱 latent heat水は融解や気化の潜熱が大きい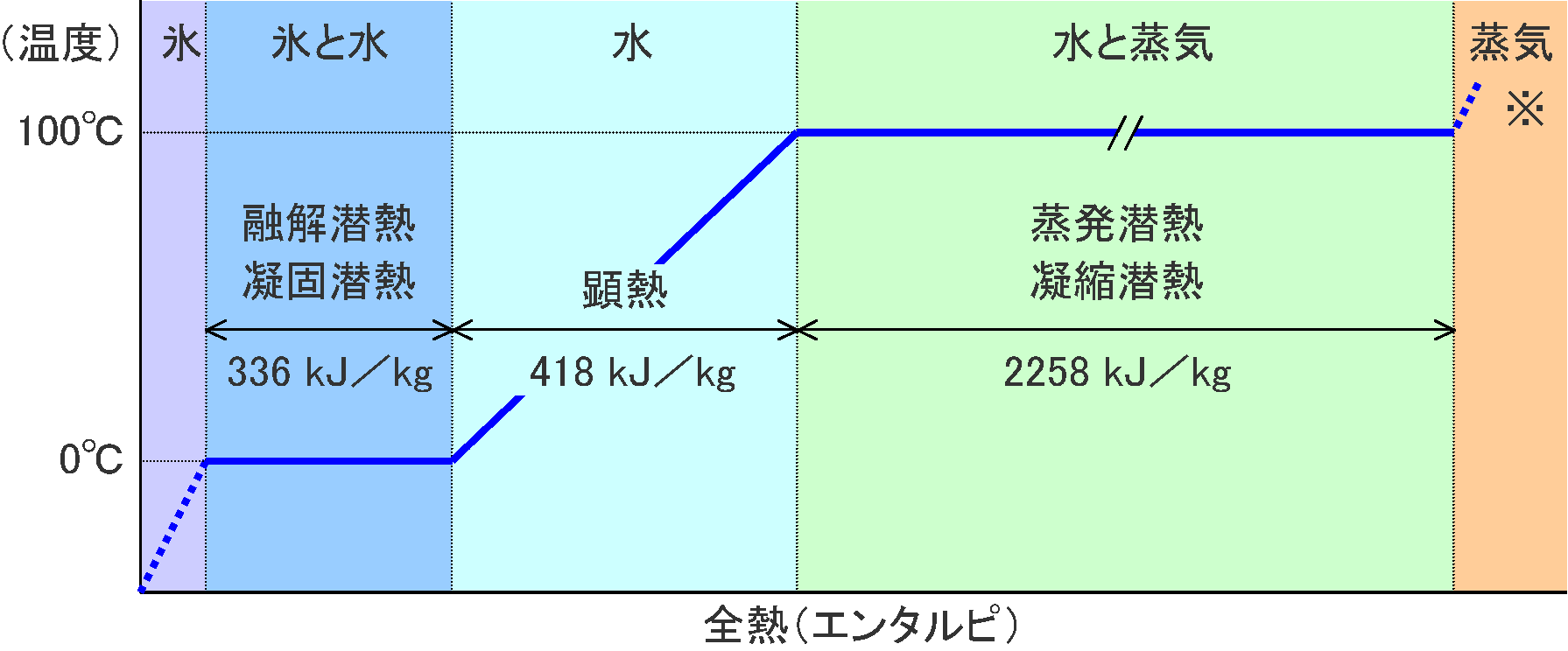
温度を一定に保ち生物の安定した内部活動に役立っている(= 外部環境への適応性を高めている) |
2. 構造的特性(a) 水素結合 hydrogen bond4.5 kcal/mol (H-O共有結合 110 kcal/mol)
静電的にHとOが引き合うことによる → みかけ上大きな分子となる (b) 分子構造電気陰性度が高いことに基づく双極子dipoleの移動氷の規則 ice rule (Barnal-Fowler rule): 氷結晶中の水素原子の位置
ほぼ正四面体 → 構造上安定: エネルギー的に安定な状態
氷の規則のみでH位置は決定しない |
|
3. 化学的特性(a) 誘電率 (ε, permittivity, dielectric constant水誘電率大 → イオン間斥力・引力を減らす → 溶解質(特に電解質)の解離を促し溶解度が増すため生体内での電解質移動を促しやすい
Benzene________2.28
NaClをH2Oに溶かすとBenzeneの約40倍の誘電率 → 容易にNa+ + Cl-という解離状態で存在 1/εs·(1/4πε0)·(c1c2/r2) = (1/4πε)·(c1c2/r2) [物質中] (b) 緩衝液少量の酸や塩基を加えてもpHが殆ど変化しない溶液緩衝作用の大きな溶液 Ex. 乳酸-酢酸塩、塩酸-クエン酸ナトリウム 一般に弱酸または弱塩基との組み合わせによる塩等の適当な混合によりpHの様々な値となる緩衝液を作る体内は中性に近い(Ex. 筋肉pHは常に7.2程度) → 乳酸がたまり引き付けを起こした時などは6.5まで下がる → ホメオスタシスの働きで正常値に戻そうとする 乳酸発酵: C6H12O6 → 2C3H6O3 (lactic acid) + 47kcal glucose + lactic acid + O2 → H2O + CO2 + ATP |
滴定曲線 Ka (mol) pK
指示薬滴定で当量点検知に加えられる試薬色変化、沈殿・濁り生成、蛍光消滅など肉眼で直接観察できる急激な変化 → 当量点を指示(一般的) 試薬に要求される事項
pH指示薬: 陽子の授受反応に応答 |
|
拡散 diffusion: 溶質分子と溶媒分子が分子運動により均等に交じり合うこと 膜を通した水移動: 生体内の水移動には膜が存在
異なる溶液接する → 自由移動分子移動 → 互いに利用可能空間を均一に使用と仮定 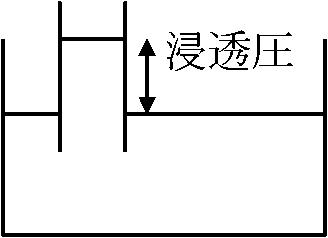 Law. 浸透圧の法則 (van't Hoff式): pv = nRT
Law. 浸透圧の法則 (van't Hoff式): pv = nRT
p: 浸透圧(圧力)
1 atom =
v: 溶液体積
= 0.082 (l·atm)/(K·mol)
T: 絶対温度 = 273 + x (°C) Hypertonic (高張) > Isotonic (等張) > Hypotonic(低張)
ψ = ψπ(in) + ψπ(out) 平衡状態
ここでAとBは隣り合っている Ex. 海岸植物・乾生植物の浸透圧は大きい Def. 自由エネルギー free energy, Δ: 外部から熱(エネルギー)を与えずに一定条件下で行う仕事として利用可能なエネルギーDef. 化学ポテンシャル chemical potential: Δ/化合物1mol
この大きさにより水の移動力は決まる
J: 透過できる粒子の数 J = D/x·ΔC
D: 拡散係数 ネルンスト式 Nernst equation: Δε = -2.3RT/ZF·log(ai/ao)
= 受動輸送の計算 R: 気体定数, F: ファラデー定数, Z: イオンチャージ, T = K Δε = -Klog(内側の濃度/外側の濃度) (イオン濃度) Def. 全ポテンシャル total potential: 植物の給水に関する全てのポテンシャル
= 単位量あたりのエネルギー
Fs: 特定方向sに単位質量の水に作用する力 ⇒ 成分に分解 (国際土壌科学学会ISSS定義)
重力ポテンシャル gravimetric potential, Z 特定点が自由水面下に沈んでいればその点の土壌中の圧力は大気圧より大きい → これによるポテンシャル 毛管ポテンシャル capillary potential, M
= マトリックポテンシャル matric potential
空気ポテンシャル pneumatic potential, G 土壌水のポテンシャルに対する全ての圧力変化を合計したもの 浸透ポテンシャル osmotic potential, O: OV = -π(dyne/cm2) ⇒ Ψ = Z + P + O重力ポテンシャル Z
W = ρ(dV)gz
dV: 基準点からzの間における微小容積(輸送される水の微小容積)
Zv = W/dV = ρgz ≡ 単位容積あたり重力ポテンシャル
p (水面から深さhにおける壌水圧力) = ρgh (dyne/cm2) dA: 断面積 (cm2), l: 長さ (cm)
SV = p (dyne/cm2) ≡ 単位面積あたりの浸水ポテンシャル → ピエゾメータ piezometerで測定 毛管ポテンシャル M (Buckingham 1907, Ψ) ⇒ 土壌水分特性τ = (2σ)/r τ : 負圧(圧力欠損) σ : 水表面張力 r: (土壌間隙の有効)半径
MV = p (dyne/cm2) ≡ 単位面積あたりの毛管ポテンシャル → テンシオメータ tensiometer (pF)で測定 空気ポテンシャル GW = dV(A'0 – A0) = dVp0
p0: 標準大気圧(p)を基準とした外部気体圧 = A'0 – A0 GV = W/dV = A'0 – A0 = p0 ≡ 単位容積あたり空気ポテンシャル A'0 = ρgh'0, A0 = ρgh0 GW = W/ρg(dV) = h'0 - h0 (cm) Def. 絶対圧 aboslute pressure, pW: 土壌水に作用する気体圧A'0を基準として測定される圧
p = pW – A'0 (dyne/cm2) |
圧力ポテンシャル P
Gと土壌水圧力pが0より大きいか小さいかによるS (or M)との総和 水理ポテンシャル φ (Φ) = Z + P = Z + (M or S) + GΦW = H (cm)
Def. 水理水頭, H = z + h + (h'0 – h0) 地下水流速 = 透水係数 × 動水勾配 → J = -K·(dh/ds) (m3/m2s = m/s) Law. ハーゲン・ポアズイユの法則 Hagen-Poiseuille law同一流下条件下 → 毛細管内を流れる水量は半径の4乗、流速は2乗に比例 Def. 水ポテンシャル water potential (ψ): Δを水特性について使用する用語 = 水の化学ポテンシャル chemical potential on water Δψ = ψA - ψB : A-B間のwater potentialの差 ⇒ 純水: ψ = 0⇒ ある系のψから純水のそれを引き、水の部分モルで割った量
水ポテンシャル(ψ)は電磁力、吸着力、表面張力、重力、弾性力等により変化するが、これらの影響する系のψは純水のψより低いことが普通なので純水のψを0 Mpaとすれば負値をとる(ψ = -吸水力)
1 bar = 10 dynes/cm² = 750 mmHg = 0.995 atom, Ex 砂糖溶液中に移動するポテンシャル Def. 圧ポテンシャル, ψp: 中に生じたポテンシャルDef. マトリックポテンシャル matric potential, τ: = 土壌の給水力。土壌中の水の表面張力によって生じたψ Def. 溶液ポテンシャル, ψ ≡= ψπ + ψp 平衡状態では、ψ(inside) = ψ(outside) 測定原理水移動測定: 拡散圧・拡散圧不足・浸透圧・吸水力等を使用し測定 (熱力学的に不十分な測定)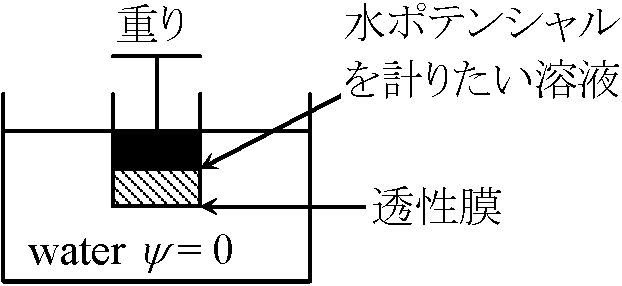 Pfeffer (生理学, 独): 溶液浸透ポテンシャル測定(図)
Pfeffer (生理学, 独): 溶液浸透ポテンシャル測定(図)
生じる圧力は溶液濃度に比例
生じる圧力は絶対温度に比例
p = RT/V, φ = -RT/V
浸透圧ポテンシャル測定1. 蒸発平衡法: 空気中ψ = 液中ψ
サイクロメーター psychrometer
R: 気体定数, T: 絶対温度, V: 水偏比容 partial molecular weight of water, P0: T0時水蒸気圧, P: 空気中水蒸気圧
1 M溶液 22.4 atom 純水よりも1.86°C下がる 膜透過性全透性: あらゆる分子を通過させる Ex. 細胞壁半透性: 溶媒は通すが溶質は通さない Ex. 細胞膜、セロハン膜 不透性: あらゆる分子も透過させない Ex. ビニール膜
液胞膜 tonoplast、表面膜 plasmalemma → 選択的透過性 differential permeability 有
水は純水 → 砂糖水へと移動し水ポテンシャルor濃度勾配を小さくする(オスモシス osmosis) 土壌からの吸水根毛 root hair におけるH2Oと水に溶けた無機物質の取りこみ地中水分・無機物質・塩類: 植物はイオンでないと養分吸収できない ↓ … 吸水力 → イオンが外から内へ移動する要因
1) 浸透圧 [→葉脈(柵状組織・海綿状組織)→ (水穴→水液) or (気孔→蒸散→水蒸気)] 根 root: 水吸収に対し適応した構造 根内部の水・栄養分移動には3様式が知られる 1. アポプラスト apoplast: 土壌中溶液がまず始め拡散により自由に広がるもので、この際はイオンが含まれる
内側apoplastの方がイオン濃度高く、内部ψπは十分大 → 外側apoplastから内側apoplastへ水移動
O2濃度: 外側 > 内側 → 呼吸によりエネルギーを得る プラスモデスム (plasmodesmata, sg. plasmodesma): 細胞連結する小穴 外側のsymplastによって内側のsymplastに取込まれる → その後導管部に送り込み取り込み過程終了 3. 移送細胞 transcellularアクアポリン (aquaporins, AQP)による移動 cf. お化け小麦: 還流法による栽培結果
還流法: 水耕液をゆっくり還流 → 非還流(通常)水耕法・畑栽培と比べ面積で2-3倍、個体で10倍の収量 |
|
乾生植物: 砂漠、海岸、高山等の礫地に多い 葉: 針状に変化し裏側に巻く。裏に皺ができ多毛。蒸散防ぐ貯水組織発達 茎: 低い。貯水組織あり 根: 大きく発達 湿性植物: 池、湖、沼、川等 葉: 通気組織は水中のため未発達、表面に気孔、水中葉は細裂-帯状で流れに耐える 茎: 通導組織が発達しない 根: 発達が悪い。吸気根を持つものがある 欠乏・蒸散水不足: 乾燥した部屋に葉を置き葉中の水を蒸発させる。水中に葉をつけると蒸散は止まる。水は1割位apoplastを通り徐々にゆっくりと蒸散が落ちる吸水力= 浸透圧 (動物細胞)= 浸透圧 – 膨圧 (植物細胞) 水ポテンシャルの差に沿い移動 → 植物体内での移動 (水ポテンシャル差生じる) 原形質分離 (限界濃度)(液胞発達した)植物細胞を高張液に浸した時、原形質体が収縮し細胞壁から分離する現象。細胞膜と液胞膜の半透性のために高張液中では細胞液が脱水されて膨圧を減じ、やがて限界原形質分離の状態(この時の膨圧0)になる。更に脱水が進めば原形質体は収縮し細胞壁から離れ、細胞液の浸透圧が外液と等しくなったとき収縮は止む原形質分離剤: 細胞膜がその溶質に対し半透性を持つことが必要で、分子量の比較的大きい非電界質(Ex 糖)や、溶解度の高い中性塩を良く用いる 半透膜 semi-permeable membraneを介し片方に溶媒(水)、他方に溶液 → 水は半透膜を通り溶液側へ浸透
→ Def. 浸透圧: 水移動を止めるために溶液側に加わる圧 植物組織を様々な浸透圧を持つ溶液に浸す
→ 限界原形質分離点での外液(等張液)臨界濃度が求まる (田崎 1985) 旱魃 drought高温空気が広範囲を覆う熱波に伴う自然現象(s.l.) 通常降水量よりも雨量著しく少なくなり水が涸れる現象 (s.s.) 農業に必要な降水足りず、収穫に多大な影響を及ぼすこと 人為: 気候変動に伴う乾燥地での降水量減少 + 保水力のある森林伐採
植物の水輸送水受動輸送 passive transport蒸散 transpiration → 大気中への水の放出ガス交換: CO2 ⇔ H2O → このガス交換の際に水が失われる → 水ポテンシャル変化 気孔 stomata開閉による: 気孔大きさ = 一般 16-12 μm、最大 100 μm |
葉 リンゴ トウモロコシ オレンジ カボチャ
表 (/cm²) 0 6047 0 2791
裏 (/cm²) 38760 9922 44961 27132
(Dounan FG 1911) ドナンの膜平衡 Dounan equilibrium移動できないイオンを持つ場合の膜平衡式半透膜片側にAB ⇔ A+ + B-, RB ⇔ R+B-のように解離するイオンを入れR+のみがこの膜を通らないとすると、A+およびB-は膜を通して他方に移るがRの存在によって膜の両側においてA+, B-の濃度に不均衡が生じつつ膜平衡に達する → 式, λ ≡ 平衡定数 λ = (膜内部の正電荷を持つイオン)/(膜外部の正電荷を持つイオン) = (膜内部の負電荷を持つイオン)/(膜外部の負電荷を持つイオン) λ: 濃度に無関係で温度と圧力のみによって変わる関数 Ex: KCl: [Ki+]/[Ko+] = [Cli-]/[Clo-] = 2/1 × n/n (参考: ゴールドマン式) 水能動輸送 active transport→ Δψに逆らった水の移動 (エネルギー代謝により促進)
受動輸送と異なる点: エネルギー消費。細胞膜透過性を利用 AFS = (組織中溶液量)/(外液の溶液量)
= 6-10% (根) ↓ 高木では根圧だけで水移動は説明できない 凝集力説: 根圧に代わる水の移動力の源として有力な説
頂部で蒸散を行うと水の結合力 cohesive force によって水が水柱状となり上部へ移動する
土壌水 根 茎 葉 空気中
ψ (水ポテンシャル) -0.5 -2 -5 -15 -1000
Δψ (lower-upper) 1.5 3 10 985
孔辺細胞の 水分調節 water adjustment蒸散作用 transpiration: 植物体から水分が蒸発すること = クチクラ蒸散(少量) + 気孔蒸散(大部分)気孔開閉 (気孔)
ガス交換の95%以上を担う種多 - 植物大型化に関与 ↓ 光合成によりCO2減少 ↓ CO2減少の結果、細胞内pHが変化する ↓ pH変化 → デンプン分解酵素働きやすくなる ↓ デンプンが分解され糖量が増す ↓ 糖(溶質分子)増加 → 孔辺細胞浸透圧⇑ ↓ 浸透圧⇑ → 孔辺細胞への水吸収すすむ ↓ 水吸収の結果膨圧が大きくなる ↓ 気孔が開く ↓ 気孔が開き蒸散が促進される 苔類では葉緑体なし 水利用効率 (water-use efficiency, WUE)Def. 葉から失われた水に対し光合成で炭素固定できた比率ジレンマ: CO2を獲得するために気孔を開くと水が逃げる Def1. 生態系: 収量(光合成量)/蒸発散量 Def2. 個葉: 光合成速度/蒸散速度 CO2獲得に気孔開く → 蒸散↑ (トレードオフ)
if 蒸散速度 ∝ 気孔開度 ⇒ WUE: 気孔の開閉を見ている ⇒ δ13CによるWUE推定 |
[水耕法 (water culture), 作物のpH (pH for crops)]
|
= 水素イオン指数 (hydrogen-ion exponent or pH) と言う人は少なかろう = ピーエッチ/ペーハー (自分が学生の頃は後者の読みが普通だったが) 活量 (アクティビティ/活動度, activity, a or A): 実質的効果を及ぼす濃度
イオン濃度高 → 量に見合った効果発揮しない μi: i成分の化学ポテンシャル, R:気体定数, T: 熱力学的温度 活量係数 activity coefficient, γ: 理想的な効果からの実質的効果のずれ
ai = γiχi
ai: i成分の活量 pH = pKa + log([A-]/[HA])
[A-]: 酸HAの共益塩基Aのモル濃度 1: H2O ⇄ H+ + OH-
Ka = [H+][OH-]/[H2O] = constant
Ka = [H+][A-]/[HA]
Ka = ([H3O+][A-])/[HA], H3O+ = H+ |
Ex 1. 0.1M CH3COOHと0.2M CH3COONaの混合液のpH
CH3COOH ↔ H+ + CHCOO- = 1.8 × 10-5 M = -log(1.8 × 10-5) = 4.74 4.74 + log(0.2/0.1) = 5.04 ∴ pH = 5.04 Ex 2. 1M CH3COOHのpH
K = ([H+][CH3COO-])/[CH3COOH] = a2/(1 - a) = 1.8 × 10-5 A. -log(aH+) = 2.08 ∴ aH+ = 0.00832 ⇒ γ = 0.00832/0.01 = 0.832 Def. pH指示薬(酸塩基指示薬) = 溶液pHにより変色する試薬
Vertebrate (3.5-4), Invertebrate (< 2), Protozoa (< 2), Higher plant (2-4), Eukaryotic algae (-0), Pilz (fungi), -0, Prokaryotic algae(4-5), Bacteria (0) |
[土壌物理, 水圏, 土壌圏 (pedosphere), 水文学]
|
土壌水の状態: 様々なイオン有機物が溶けている
水の流束qに対する抵抗 r ⇒ q = Δψ/r 水の移動性を決める
遮水壁: 地表面乾燥極端に進む → 抵抗増大(負圧増大)し水は水蒸気体としてしか移動できない – 遮水壁形成 a. 粒度特性: 砂質土は毛管保水が中心で、高い吸引圧に対し弱くいため急激に含水率が低下するが、粘質土では比表面積が広く表面保水が卓越し、ある程度高い吸引圧に対しても含水率を維持できる
[比表面積] = [表面積/重量] – 物質が細分化されるたび、新しい表面積が増え大きくなる c. 間隙特性: 土壌水分特性曲線が描くよう、砂質土のような粗い間隙では吸引圧は小さく保水性は低いが、粘質土のような微細な間隙では吸引圧が大きいため保水性は高い = 水もち、水はけ 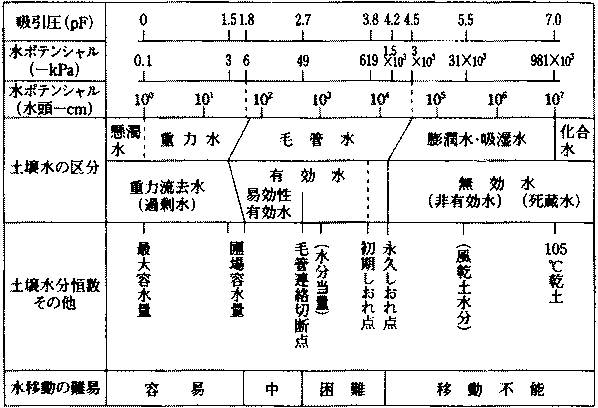
土壌水分測定法 |-------砂柱法-------||--------加圧板法--------|________|------蒸気圧法------| _____________|-----------水柱吸引法-----------|___|-圧膜法・遠心法-| __________________________|-吸引法(減圧法)-| _____________|-------------テンシオメーター-------------| _____________|---------ナイロンブロック---------||---石膏ブロック---| _____________|------------------------熱伝導度法-----------------------| _____________|---------乾熱法・実容積法・中性子法・誘電体法・サイクロメーター---------| 土壌水分区分と水ポテンシャル・水分恒数 → 水ストレス (water stress) テンシオメーター(テンションメーター) tensiometer: pF測定器具
土壌との密着性悪いと直ぐ空気が入る - 実際は正確測定困難 水分恒数 water constant植物応答が変化する水分状態変化点 Ex. 萎凋点・永久萎凋点・粘着点 |
Def. 萎凋点(萎れ点, 萎凋係数) wilting point (wp) 土壌水分を減少させたとき植物が萎れ始める点 ⇒ pF ≈ 3.8 Def. 一時萎凋点 temporary wp植物萎れるが水与えると回復する最少含水量 ⇒ pF ≈ 3.9 永久萎凋点 permanent wp: 飽和湿度(100%)に戻しても回復しない含水量
pF ≈ 4.2 ⇒ 15気圧で吸着保持されている水は植物利用可能 永久萎れ率 permanent wilting percentage: その土壌水分量 水分当量 moisture equivalent湿土に重力の1000倍の遠心力を与えても土壌中に残る水分(%)
pF = 2.7-3 ⇒ 大孔隙中の毛管水は殆どない
乾土に湿土を接触 → 毛管力により湿土から乾土に水移動 → 容水量(保水量) water holding capacity, whc土壌が孔隙中に保持できる水分量 ≈ 降雨直後の土壌含水量
⇒ 保水性 (= 水移動力) → 植物成長 ≈ 土壌の全空隙量 → 土壌から水を取り去る力が働いてない状態 Ex. 湛水状態の水田 → pF = 0 [湿原] 停滞水面と接する直上部にある土壌の水分 圃場容水量 field capacity (≈ 最少容水量 minimum whc):重力水0となり水下方移動ない状態の水分量
= 土壌が重力に反し保持できる最大水分量 → pF = 1.5-1.7 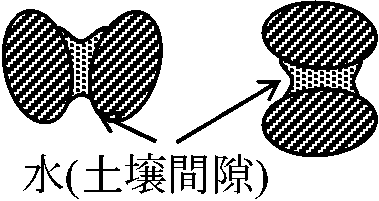 有効水: 植物利用可能な水 ≈ 毛管水 → pF ≈ 1.5-4.0
有効水: 植物利用可能な水 ≈ 毛管水 → pF ≈ 1.5-4.0
= 團場容水量 - 萎凋点 ⇒ 成長の水分上の決め手 粘着点 sticky point乾土(粘着性0) → 少量ずつ水加える → 粘着性 Ex. 指付着 = 粘着点水分比 (%)含水率 = 水分重量/湿土重量 × 100 (%), 農学分野含水比 = 水分重量/乾土重量 × 100 (%), 農業土木分野 体積含水率 (水分率) = 水分容積/土壌容積 × 100 (%) = 含水比 × 仮比重 → TDR 水分張力植物-土壌水関係および土壌粒子-水吸着保持力関係を表わす指数(Schofield 1935) pF・含水率pF = logh (h: 水柱の高さ)
結合水: 原形質内の構造と結合してその構成成分となっている水
= (Wwet – Wdry)/Wdry) = (W1 – W2)/(W2 – W0) × 100
W0: 容器重量 mc' = (Wwet – Wdry)/Wwet) ⇒ mc = mc' × (mwet/mdry) 体積水分率(体積含水率) (v, %): v= (W1 – W2)/Vt × 100 Vt: 採取容器体積 |
水を不要とする実験は少ない
純水 purified water物理/化学処理 → 不純物除去 → 純水 ≈ 蒸留水 distilled water (DW) + イオン交換水= 主に塩類や残留塩素が殆ど全て除去された水 → 単にフィルター・活性炭等で濾過しただけでは純水と呼ばない
除去方法: 長所 ↔ 短所
UF(限外濾過)膜: コロイドや高分子の除去 → ミリポア・ミリQ (Milli-Q) (商標名, 超純水) オートスチル(商標名): イオン交換法 → 蒸留法 基本操作ピペット
先端目盛: 一定目盛まで吸い上げた液を全て落とす 中間目盛: 一定目盛まで吸い上げた液を最後の目盛まで落とし止める
(a) メスピペット混用避ける(ビンに入れたままにしておく。各液専用ピペット決める) 2. マイクロピペット 微量の液体の分取等に使用 (20 μl, 200 μl, 1000 μl用等)
Ex. ピペットマン, ギルソン社商標: 誤差の個人差はピペットより小 |
手順
約2気圧下の飽和蒸気圧下で121°C で15-20分間滅菌する方法
(2021/08/10) 実験室の水汲み
|
固体・液体混合物を固体を通さない網目の膜を通過させ分離する操作
準備フィルター(濾紙)漏斗: 濾紙の畳み方で濾過効率は大きく変化
漏斗 必要に応じ、減圧器・加圧器 |
吸引濾過アスピレータ・減圧器等により減圧し吸引濾過鐘 濾紙 filter paperグラスファイバーフィルタGF/F: 水質分析用水の濾過に一般に使用珪酸イオンコンタミに注意 メンブランフィルタセルロースアセテートメンブランフィルター: 孔径0.2 nm水質分析標準 (Advantec Toyo) |
|
全項目分析に必要なサンプル量は、最低100ml(理想250ml)。冷凍保存
サロベツでは、測定項目絞って50 ml → クアトロ 全窒素, 全リンペルオキシ2硫酸カリウムで酸化分解後、220 nmか880 nm吸光度測定し定量か、全窒素・全リン分析計を使用。全窒素・全リン分析計では、溶存態(0.5ミクロンフィルター通過するもの)に限られる NH4+, NO2-, Cl-, SO42-, K+, Na+, Ca2+, Mg2+: イオンクロマトグラフで分析Fen+, SiO2: ICPで分析する(鉄は、2価と3価を分け測定するなら機器分析では不可能) イオンクロマトグラフ(IC)HPLCの1種。水溶液中イオン成分を分離し分析する装置
溶離液(移動相)に電解質水溶液を用い、固定相にイオン交換樹脂充填カラム使用 |
試料前処理液体試料: 純水抽出、希釈と濾過操作を行い、試料中主成分と微量不純物成分測定固体試料: 熱水、超音波等による純水抽出で表面付着汚染成分、並びに加水分解等による生成成分測定 他に、有機化合物中のハロゲン、リン・イオウ等の含有量分析に燃焼ガスサンプリング法等がある Ex. ダイオネックス, DX-120 溶存酸素 dissolved oxygen, DO測定法
|